? ? ? ?來源:細胞王國 ? ? ? ?癌癥的發生從來就不是一朝一夕的事。 ? ? ? ?從歷史的角度看,癌癥伴隨人類進化了上千年。科學家們在古埃及木乃伊中就已發現了癌癥存在的證據。這一張牙舞爪的魔鬼伸出長長的觸手,把死亡的恐怖散播到全身各處。Cancer,另一個意思是螃蟹,恰好來源于古希臘人對于這一病癥的形象描述。而可以肯定的是,癌癥的陰霾至少還將縈繞在人類頭頂半個世紀。 ? ? ? ?現代醫學最先進的成像儀器也難以檢測到1mm大小的腫瘤,但這么小的腫瘤已經包含了一百萬個癌細胞。當腫瘤長大到1cm時,也就是增強CT掃描圖像中的一個小結節,腫瘤內的癌細胞已經多達十億個。 ? ? ? ?假設腫瘤完全不受控制地增長,每2天就能翻一倍(事實上許多癌細胞系在體外培養的速度比這還要快,幾乎每天翻一倍),那么一個癌細胞只需要不到半年就能取代身體所有的細胞。事實上癌細胞總質量達到1kg時其消耗的能量和代謝廢物足以殺死一個成年人。然而從一個癌細胞生長到現代醫學可以檢查出來的腫瘤,往往需要5-10年時間。一方面,癌細胞并不是生來就“惡”的,它需要積累足夠多的基因突變完成量變到質變的過程;另一方面,癌癥的發生需要逃過身體免疫細胞的重重關卡。 ? ? ? ?早在1909年,德國科學家Paul Ehrlich就提出了最初的癌癥免疫假說:在生長發育過程中難免會產生異常細胞,但鮮有人因此罹患癌癥,這一切都歸功于免疫系統系統的保護。但受限于當時的技術水平和認知,該假說并不能用實驗手段驗證。30年后,美國科學家Lewis Thomas提出,免疫系統通過識別腫瘤特異抗原來清除體內的癌細胞,即所謂的免疫監視理論(immune surveillance theory)。1953年,Frank MacFarlane Burnet通過異體移植模型初步證明了他的猜想:將致癌物誘導產生的腫瘤移植到同一品系的小鼠身上,會馬上被排斥;而正常組織移植則不會。 ? ? ? ?隨后,對T細胞、NK細胞、抗原呈遞細胞功能的深入研究補充了免疫監視理論的細節。2002年,Robert Schreiber等人提出免疫編輯(immunoediting)理論,進一步完善了腫瘤免疫的框架。在他的理論中,腫瘤的發展需要經過三個免疫階段:
1. 消除(elimination):初期癌細胞很容易被NK、T細胞殺死; 2. 平衡(equilibrium):腫瘤積累一定突變后,能抵抗胞毒性細胞的追殺,與免疫細胞平起平坐; 3. 逃逸(escape):繼續發生突變,解除免疫細胞對腫瘤的生長抑制,開始形成臨床可檢測的腫瘤。腫瘤的生長類似于物種進化,在免疫系統的選擇壓力下,只有能成功逃脫免疫反應、擁有強大生存能力的腫瘤細胞才能幸存下來。 J Clin Invest. 2007;117(5):1137-1146. https://doi.org/10.1172/JCI31405.
? ? ? ?與外源性病原體不同,癌細胞來源于正常細胞,表達正常細胞表達的幾乎所有蛋白,因此更難被免疫系統區分。細菌、病毒靠著強大的進化能力一次次逃過了免疫細胞的火眼金睛,同樣癌細胞也能通過不斷進化偽裝自己。況且在免疫系統的軍隊里,不同類型的細胞發揮的功能截然不同,有些甚至會阻止友軍殺敵。淋巴細胞里,B細胞在腫瘤面前基本是個瞎子(很難有可以被BCR識別的腫瘤抗原,而T細胞和NK細胞才是殺滅腫瘤的主力軍。但并不是說B細胞對于抗腫瘤一點用都沒有,除了分泌抗體以外,B細胞還可以作為抗原呈遞細胞、分泌細胞因子,這些對于抗擊腫瘤來說還是有巨大的幫助)髓系細胞里,同樣是抗原呈遞細胞,樹突狀細胞出現在腫瘤里的頻率往往和好的預后相關,而巨噬細胞卻往往和不良預后掛鉤(尤其是M2型巨噬細胞)。 ? ? ? ?同樣包括在豬隊友名單里的還有中性粒細胞以及調節性T細胞(Treg),甚至還有不屬于免疫系統的成纖維細胞(觀戰者)。目前這些細胞在腫瘤中的具體作用和分子機制還沒有徹底研究清楚,留在我們面前的還是一個大黑箱。 ? ? ? ?而利用免疫系統來治療癌癥,早在理論橫空出世前就被應用到了臨床。1891年,美國醫生William Coley意外發現術后化膿性鏈球菌感染能使肉瘤患者腫瘤消退,并將其運用于治療骨癌和軟組織肉瘤。這一發現打開了癌癥免疫治療的先河。然而在那個時代,免疫系統對于科學家來說還是一個黑箱子,且在抗生素被發現之前,對于人類最大的威脅并不是癌癥,而是細菌、病毒引發的傳染病。1946年起,隨著二戰結束,美國癌癥協會(ACS, American Cancer Society)累計拿出36億美元支持癌癥研究。在抗生素有力控制了細菌感染后,癌癥開始受到更多國民的關注。化療、放射線療法等更強力有效的治療手段出現使科學家暫時擱置了不那么成熟有效的免疫療法。 ? ? ? ?上世紀70年代,美國總統尼克松頒布法案支持國立癌癥中心(NCI, National Cancer Institute),并撥出1億美元科研經費,這場被稱為第二個登月計劃的抗癌戰爭正式打響。美國醫生/科學家Steven Rosenberg是該計劃的收益者之一。1968年,他偶遇了一位癌癥晚期自愈的病例,從此醉心于癌癥免疫研究一發不可收拾。1974年起,他開始嘗試一種叫做過繼性細胞輸入(adoptive cell transfer,ACT)療法。簡單地說,就是從患者體內分離T細胞,經過體外擴增培養,再輸回患者體內。他們發現一種叫IL-2的細胞因子可以刺激T細胞增殖,并在病人身上注射IL-2。不幸地是,IL-2激活免疫反應的能力使得許多病人產生了強烈副作用,且在前66位病人中均沒有控制住腫瘤瘋漲。奇跡終于在第67號病人上出現了:在接受了T細胞回輸和IL-2聯合治療后,這位惡性黑色素瘤患者全身多處轉移灶完全消失,并存活至今。這一成功大大鼓舞了癌癥免疫學研究,因為它首次證實,僅通過靶向免疫系統而不靶向癌細胞,也可以治療腫瘤。然而ACT僅能對極少數黑色素瘤和腎癌患者有效。
【參考:Coley toxin for treatment of sarcoma Adoptive Cell Transfer as Personalized Immunotherapy for Human Cancer】
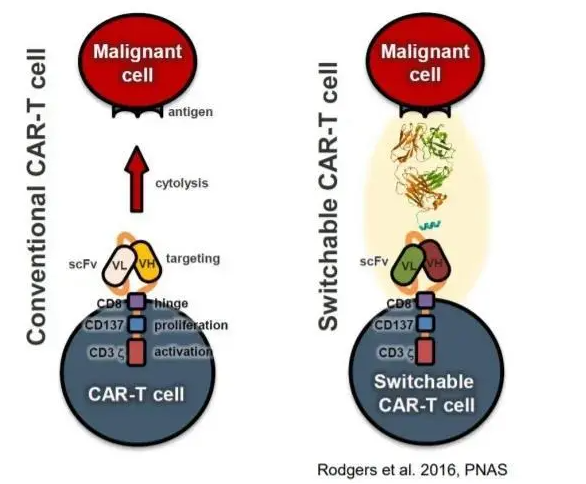
? ? ? ?另一個癌癥免疫治療的傳奇故事則來源于以色列科學家Zelig Eshhar的一個腦洞。上世紀90年代,人們已經知道了T細胞受體(TCR),并初步了解了T細胞通過TCR識別MHC上的抗原肽鎖定目標 的機制。Eshhar于是提問:能否將TCR的膜外區域改造成BCR,從而使T細胞識別天然狀態的蛋白而不是經過蛋白酶消化呈遞的肽段?嵌合抗原受體T細胞(Chimeric Antigen Receptor T cell, CAR-T)由此誕生。由于歷史原因(1980年代HIV 被發現,因其無藥可治在當時被稱為超級癌癥),最初設計CAR-T的初衷并不是用來治療癌癥,而是治療艾滋病的。 ? ? ? ?在改造CAR-T功能上,美國科學家Carl June做出了很大貢獻。隨著何大一等人開發出雞尾酒療法,CAR-T這一繁瑣的技術在治療HIV上立刻顯得相形見絀。機緣巧合下,June將目光轉到了腫瘤上。許多腫瘤會表達正常組織不表達的腫瘤特異抗原(tumor-specific antigen),如果T細胞能識別它們,不就可以達到靶向殺死腫瘤的目的嗎?CAR-T技術的誕生得益于日趨成熟的分子克隆和轉基因技術,在此以前,要讓淋巴細胞表達特定外源基因是一件極其困難的事。第一代CAR的胞外域和后續一樣,都是單鏈抗體可變區融合蛋白scFv,用一條flexible linker連接單克隆抗體的輕重鏈可變區域(其實在最初科學家想用抗體的輕重兩鏈,但發現這樣表達效率極低);變化的是胞內區:第一代直接用CD3ζ(這是一個ITAM,即刺激下游T細胞激活的信號轉導結構域),而隨后的第二代、第三代CAR采用了多個共刺激結構域增強CAR-T的信號,使其擁有更高戰斗力。 ? ? ? ?十五年后,針對CD19的第三代CAR-T細胞在治療頑固性B細胞白血病的臨床實驗中大放異彩,CAR-T終于在癌癥免疫療法中奠定了一席之地。隨后,可變的(switchable) CAR-T也開始亮相,科學家開始在胞外域上做文章:與其直接識別腫瘤抗原,不如在腫瘤抗原和T細胞嵌合受體上增加一個小把柄,只有加入這個特定的中間媒介才能讓T細胞正常工作。這樣就可以在不降低療效的同時有效控制CAR-T防止過度激活引發的細胞因子風暴。 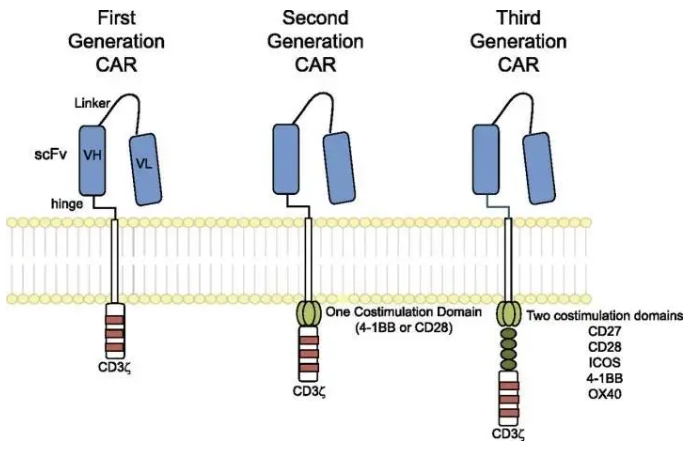
? ? ? ?和CAR-T一樣值得被載入史冊的,當屬2018年諾貝爾生理醫學獎獲獎研究——免疫檢查點抑制劑與癌癥治療。免疫檢查點的發現同樣來源于過繼性T細胞療法中對T細胞功能的研究。當時已經發現B細胞、T細胞的激活不僅需要BCR/TCR,還依賴于共刺激信號分子,包括CD28家族的十多個成員,以及他們的配體,B7家族蛋白。抗原呈遞細胞(APC)表面的共刺激分子決定了淋巴細胞的活化和抑制,這一功能有助于決定免疫系統何時出戰何時停戰,避免過度激活誤傷無辜。 ? ? ? ?CTLA-4和PD-1是T細胞表面表達的兩種重要共刺激信號分子,且均在 T細胞過度激活發生耗竭(exhaustion)前開始表達。CTLA-4的配體,B7-1和B7-2都只在專業的抗原呈遞細胞上表達,而PD-1的配體PD-L1卻在很多正常組織細胞上表達。腫瘤細胞發現了免疫系統的這個bug,它們也紛紛高表達PD-L1這個正常組織的“良民證”,非法逃避免疫系統追殺。堵住PD-1與PD-L1結合可以有效解除腫瘤細胞對T細胞的抑制作用。2014年,PD-1單克隆抗體Keytruda正式被美國藥監局FDA批準,用于治療轉移性惡性黑色素瘤。次年,美國前總統Jimmy Carter使用該藥物治療晚期轉移性黑色素瘤,取得了奇跡般的效果。和IL-2相比,PD-1/PD-L1單克隆抗體的副作用更小,對于某些腫瘤晚期患者的生存率有了極大提高,甚至能達到完全治愈的效果。 Costimulatory molecules as adjuvants for immunotherapy, Frontiers in Bioscience 11:788-803 (2006)
? ? ? ?近年來,癌癥免疫療法成為繼手術、化療、放療和靶向療法后的又一大支柱,除了上文提及的ACT、CAR-T和免疫檢查點抑制劑以外,天然免疫激活劑(如STING agonist、CpG等)、溶瘤病毒(如T-VEC)以及癌癥個性化疫苗等靶向免疫細胞的新興手段使得越來越多原本無可救藥的患者看到了希望。然而必須承認的是,“道高一尺,魔高一丈”,我們只是在征服癌癥的漫漫長路上邁出了很小的一步,卻始終沒有意識到:我們的對手,就是我們自己。癌癥的夢魘原本就寫在我們的基因里,而它的解,也許也藏在我們32億堿基對中。 ? ? ? ?如涉及知識產權請與我司聯系
|