西晉司馬彪有詩云“卞和潛幽冥,誰能證奇璞” “奇璞”寓意珍奇美玉或才智出眾之人
仿制藥質(zhì)量和療效一致性評價政策出臺、藥品集采升級、“國談”常態(tài)化的影響下,me-too等創(chuàng)新藥和仿制藥的價值空間被極大壓縮,加速了藥品行業(yè)業(yè)態(tài)的不斷調(diào)整和發(fā)展,激發(fā)創(chuàng)新藥研發(fā)動力,驅(qū)動著藥品質(zhì)量升級,擁有自主知識產(chǎn)權(quán)且療效確切的藥品或具有真正意義創(chuàng)新藥的藥企方能乘風破浪。
——?——
2022“奇璞獎”歷時三個多月的創(chuàng)新項目征集,得到了全國各地健康產(chǎn)業(yè)人士的積極響應(yīng)和支持。最終,經(jīng)過評審組的嚴格篩選,260多個創(chuàng)新項目(數(shù)量同比增幅超過40%)成功進入第四屆“奇璞獎”入圍名單。
讓我們通過梳理2022奇璞獎「藥品行業(yè)創(chuàng)新」賽道入圍項目的亮點,一起看看藥企如何乘風破浪、一騎絕塵吧~
上海輝啟生物醫(yī)藥科技有限公司 「基于免疫治療疾病的小分子藥物研發(fā)」 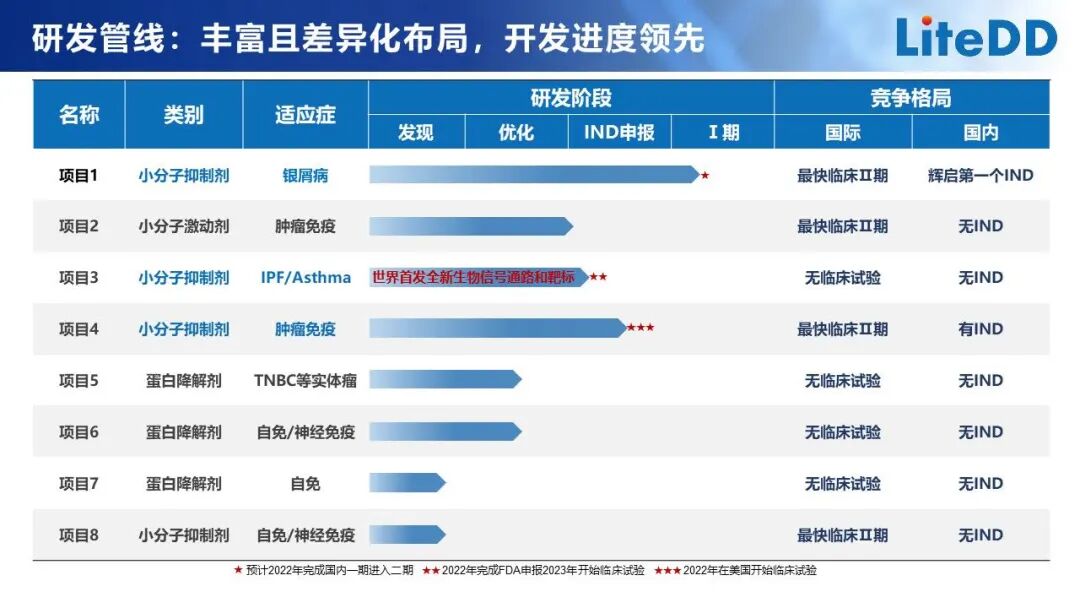
上海輝啟生物醫(yī)藥科技有限公司成立于2018年,專注于自身免疫、腫瘤免疫和神經(jīng)免疫疾病領(lǐng)域,已快速發(fā)展成為國內(nèi)領(lǐng)先的聚焦先天淋巴細胞免疫的FIC創(chuàng)新藥研發(fā)企業(yè)。
其特色是: 1、創(chuàng)造性地提出了全新的化合物庫的設(shè)計理念,建立了獨特創(chuàng)新的蛋白降解劑高通量篩選技術(shù),通過巧妙新穎的設(shè)計解決了困擾蛋白誘導降解分子發(fā)現(xiàn)領(lǐng)域的難題。
2、已建立了以精準疾病機制引導的基于先天淋巴細胞免疫技術(shù)、蛋白誘導降解分子高通量篩選技術(shù)和臨床轉(zhuǎn)化醫(yī)學技術(shù)的創(chuàng)新藥物研發(fā)平臺,呈現(xiàn)出快速發(fā)展的研發(fā)產(chǎn)品管線。
目前已獲得4個項目的PCC,其中1個項目獲得了FDA和NMPA臨床試驗許可,正在開展國內(nèi)臨床1期研究;另2個正進行IND使能研究,其中一個是基于自有技術(shù)于世界上首次發(fā)現(xiàn)的靶標用于治療IPF和哮喘的小分子候選藥物,另一個是基于公司自身轉(zhuǎn)化醫(yī)學技術(shù)發(fā)現(xiàn)的全新作用機制的FIC小分子,對帶有特定生物標記物的腫瘤具有很好的療效。
優(yōu)時比貿(mào)易(上海)有限公司 「針對育齡期女性類風濕關(guān)節(jié)炎的治療藥物希敏佳(培塞利珠單抗)」  
2021年中國開放“三孩政策”,對人口長期均衡發(fā)展具有重大意義。然育齡期女性健康,需要更多關(guān)注。類風濕關(guān)節(jié)炎是一種以侵蝕性關(guān)節(jié)炎為主要臨床表現(xiàn)的自身免疫疾病,患者備受疾病折磨,尤其對于正值育齡期的女性患者而言,如果未能得到有效治療還會被迫推遲或改變生育計劃。
優(yōu)時比是一家全球性生物醫(yī)藥公司,總部位于比利時布魯塞爾,專注于開發(fā)免疫系統(tǒng)和神經(jīng)系統(tǒng)重癥疾病的創(chuàng)新藥物和療法。其開發(fā)的創(chuàng)新產(chǎn)品培塞利珠單抗注射液(CZP),用于中重度活動性類風濕關(guān)節(jié)炎治療,從分子結(jié)構(gòu)的設(shè)計上就考慮到女性患者的特殊關(guān)切點,幾乎無胎盤轉(zhuǎn)運,是中國獲批唯一在說明書中注明如有臨床需要孕期全程均可使用的治療類風濕關(guān)節(jié)炎的生物制劑。
其特色是: 根據(jù)美國、歐洲、英國多個國家的權(quán)威指南,培塞利珠單抗注射液(CZP)是目前唯一的一種被明確推薦在有臨床需求時,可用于備孕期、妊娠期全程和哺乳期女性風濕病患者的TNF-α抑制劑。中華風濕病學會《風濕性疾病患者圍妊娠期藥物使用規(guī)范》指出,培塞利珠單抗為妊娠期首選TNF抑制劑。
同時,為提升患者可及性與可負擔性,優(yōu)時比積極發(fā)展商業(yè)健康險,并在持續(xù)探索更廣泛的慢病用藥保障,以及積極的與有關(guān)部門、行業(yè)協(xié)會及合作伙伴攜手提升風濕疾病的診療及疾病管理水平。
亞盛醫(yī)藥 「中國首個且唯一一個第三代BCR-ABL抑制劑:奧雷巴替尼(商品名:耐立克?)」 
獲得性耐藥一直是慢性髓細胞白血病(CML)治療的主要挑戰(zhàn),盡管隨著靶向BCR-ABL的酪氨酸激酶抑制劑(TKI)的問世,CML的治療方式得以革新。但仍有部分患者因耐藥導致疾病進展甚至死亡。其中,BCR-ABL激酶區(qū)突變是TKI治療后耐藥的重要機制之一,T315I突變是最常見的耐藥突變類型,在耐藥CML中的發(fā)生率達25%左右。攜T315I突變耐藥CML患者對所有一代、二代BCR-ABL抑制劑均耐藥,此前長期面臨無藥可醫(yī)治的窘境。
打破無藥可醫(yī) 亞盛醫(yī)藥原創(chuàng)1類新藥耐立克,于2021年11月獲批在中國上市,是中國首個且唯一一個獲批上市的第三代BCR-ABL抑制劑,打破了中國攜T315I突變耐藥CML患者長期無藥可醫(yī)的困境。
具全球Best-in-class潛力 臨床數(shù)據(jù)顯示,耐立克的療效媲美全球首個上市的第三代BCR-ABL抑制劑;安全性初步顯示更優(yōu)。
目前,耐立克共獲3項美國FDA孤兒藥資格認定和1項歐盟孤兒藥資格認定,并獲1項FDA審評快速通道資格。
上海宇耀生物科技有限公司 「AI引領(lǐng)創(chuàng)新小分子藥物研發(fā)」  
宇耀生物以“專注創(chuàng)新,造福人類健康”作為企業(yè)使命,專注自有知識產(chǎn)權(quán)創(chuàng)新藥物的開發(fā)與研究,目前已搭建GPCR藥物開發(fā)平臺、“Undruggable”藥物開發(fā)平臺和AI藥物輔助開發(fā)平臺3大全球領(lǐng)先的技術(shù)平臺;在研的8款創(chuàng)新產(chǎn)品,針對難治及復(fù)發(fā)性實體瘤、血液腫瘤,神經(jīng)退行性疾病以及自身免疫病等疾病種類進行全方位布局。
YY001是宇耀生物自主研發(fā)的新一代EP4受體小分子拮抗劑,也是國內(nèi)首個自主原研高選擇性EP4受體拮抗劑,通過靶向腫瘤免疫微環(huán)境,治療PD-1抗體敏感和不敏感的晚期實體瘤。
YY001目前正在上海東方醫(yī)院開展臨床1期研究,相較處于臨床試驗各階段的競品,臨床前研究數(shù)據(jù)顯示,其靶點活性提高了5-10倍, 口服生物利用度提高2倍,體內(nèi)血藥濃度提高了4倍,是一款有潛力的“first-in-class”產(chǎn)品;臨床前藥效研究顯示其在結(jié)直腸癌、胃癌和前列腺癌等晚期實體腫瘤中表現(xiàn)出顯著的抗腫瘤作用,并且在和PD-1抗體聯(lián)用時顯著增強治療效果,有望將PD-1抗體治療不敏感的“冷腫瘤”轉(zhuǎn)變?yōu)椤盁崮[瘤”,為晚期實體瘤的治療提供新的策略,造福更多的中國乃至全球晚期癌癥患者。
榮昌生物制藥(煙臺)股份有限公司(兩個創(chuàng)新項目) 「治療自身免疫性疾病的雙靶標TACI-Fc融合蛋白--泰它西普」 
泰它西普(泰愛?)是由榮昌生物自主研發(fā)的全球首款、同類首創(chuàng)(first-in-class)的注射用重組B淋巴細胞刺激因子(BLyS)/增殖誘導配體(APRIL)雙靶點的新型融合蛋白產(chǎn)品。
其特色是: 具有新靶點、新結(jié)構(gòu)、新機制的特點,可同時抑制BLyS和APRIL兩個細胞因子與B細胞表面受體的結(jié)合,“雙管齊下”阻止B細胞的異常分化和成熟,從而治療自身免疫性疾病。
發(fā)明專利先后獲得中國、美國、歐洲等國家和地區(qū)的授權(quán),得到了國家“十一五”、“十二五”、“十三五”期間“重大新藥創(chuàng)制”科技重大專項支持。2021年3月,泰它西普系統(tǒng)性紅斑狼瘡適應(yīng)癥獲得國家藥品監(jiān)督管理局批準上市銷售,并于同年12月被批準納入新版國家醫(yī)保目錄。
目前,該藥用于自身免疫性疾病領(lǐng)域的其他6個適應(yīng)癥(包括視神經(jīng)脊髓炎譜系疾病、類風濕關(guān)節(jié)炎、IgA腎病、干燥綜合征、多發(fā)性硬化癥與重癥肌無力等)正處于Ⅱ期或Ⅲ期臨床試驗階段,系統(tǒng)性紅斑狼瘡Ⅲ期和IgA腎病Ⅱ期全球多中心臨床研究正在穩(wěn)步推進。
「抗體偶聯(lián)藥物(ADC)新藥——維迪西妥單抗」 
維迪西妥單抗(商品名:愛地希?)是由榮昌生物研發(fā)的中國首個原創(chuàng)抗體偶聯(lián)(ADC)藥物。
其特色是: 以腫瘤表面的HER2蛋白為靶點,能精準識別和殺傷腫瘤細胞,在治療胃癌、尿路上皮癌、乳腺癌等腫瘤的臨床試驗中均取得了卓越的臨床數(shù)據(jù)。
是我國首個獲得美國FDA、中國藥監(jiān)局突破性療法雙重認定的ADC藥物。交易額刷新中國制藥企業(yè)單品種海外授權(quán)的最高紀錄。2021年6月,維迪西妥單抗胃癌適應(yīng)癥獲中國藥監(jiān)局批準上市銷售,并于同年12月被批準納入新版國家醫(yī)保目錄,于12月被納入《新型抗腫瘤藥物臨床應(yīng)用指導原則(2021年版)》。
尿路上皮癌適應(yīng)癥于2021年12月獲中國藥監(jiān)局批準上市銷售,治療乳腺癌、肺癌、膽管癌等其他適應(yīng)癥的Ⅱ/Ⅲ期臨床研究正在推進,其中乳腺癌適應(yīng)癥被CDE正式納入突破性治療品種。
嘉和生物藥業(yè)有限公司 「Lerociclib細胞周期蛋白依賴性激酶CDK4/6抑制劑」 
嘉和生物藥業(yè)(簡稱“嘉和生物”,港股上市)是一家創(chuàng)新驅(qū)動型生物制藥公司,強大的產(chǎn)品管線涵蓋全球前三大腫瘤(乳腺癌、肺癌、胃腸道腫瘤)和血液腫瘤,正著力打造一個具備藥物創(chuàng)新研發(fā)、臨床前研究、臨床開發(fā)、注冊、CMC開發(fā)以及商業(yè)化生產(chǎn)的創(chuàng)新性、平臺型、一體化公司。?
據(jù)世界衛(wèi)生組織國際癌癥研究機構(gòu)(IARC)發(fā)布的全球最新癌癥數(shù)據(jù)顯示,2020年中國乳腺癌新發(fā)病例數(shù)42萬、死亡人數(shù)達12萬例。晚期乳腺癌患者的5年生存率較低,其中占比較大的是HR+/HER2-型患者。而在中國乳腺癌患者中,HR+/HER2-型患者的占比約為62%,是HER2+乳腺癌患者人數(shù)的2.8倍,患者治療需求巨大。
GB491(Lerociclib細胞周期蛋白依賴性激酶CDK4/6抑制劑)是由嘉和生物和美國G1 Therapeutics共同開發(fā)的一款用于治療乳腺癌的高選擇性口服型CDK4/6抑制劑。
據(jù)2020年歐洲腫瘤學術(shù)大會(ESMO)上發(fā)表的資料,GB491(Lerociclib)在HR+/HER2-晚期乳腺癌患者的2線治療中響應(yīng)率達到31.6%,相比現(xiàn)有中國已獲批上市的CDK4/6藥物呱柏西利24.6%的響應(yīng)率更佳;在安全性方面,較Inbrance、Kisqali和Verzenio顯示出更優(yōu)的安全性和耐受性,可以通過較低的劑量限制性毒性和較少的病患監(jiān)護連續(xù)給藥,有望成為潛在同類最佳CDK4/6藥物。
嘉和生物于2021年5月向國家藥監(jiān)局遞交GB491兩項針對HR+/HER2-局部晚期或轉(zhuǎn)移性乳腺癌患者的多中心、隨機雙盲、安慰劑對照3期關(guān)鍵研究新藥臨床試驗申請(IND)。其中:二線3期臨床試驗于2021年6月EC批準,并于10月完成首例患者給藥;一線3期臨床試驗于2021年8月EC批準,于2022年1月完成首例患者給藥。作為有望成為前三款面市的國產(chǎn)CDK4/6藥物,GB491將為乳腺癌患者帶來優(yōu)秀的、多樣性的治療選擇。
江蘇恒瑞醫(yī)藥股份有限公司 「注射用卡瑞利珠單抗;羥乙磺酸達爾西利片」 
羥乙磺酸達爾西利片是恒瑞醫(yī)藥自主研發(fā)的口服、高效、選擇性的小分子CDK4/6抑制劑,屬于化藥1類新藥。
其特色是: 作為一種新型高選擇性CDK4/6抑制劑,達爾西利在藥物分子結(jié)構(gòu)上進行了創(chuàng)新,引入哌啶基團,降低臨床潛在肝臟毒性,具有更高腫瘤/血漿分布比例。
是中國自主研發(fā)的首個聯(lián)合內(nèi)分泌治療在晚期乳腺癌Ⅲ期臨床試驗中獲得積極結(jié)果的CDK4/6抑制劑,DAWNA-1研究入組的361例患者100%為中國患者,更貼近中國患者診療現(xiàn)狀。先后被CDE授予突破性治療品種和優(yōu)先審評審批,快速通過審批上市,目前已達成全國商業(yè)銷售。
達爾西利獲批上市,主要是基于DAWNA-1研究 :一項多中心、隨機、對照、雙盲Ⅲ期臨床研究,旨在對比達爾西利與安慰劑加氟維司群治療既往經(jīng)內(nèi)分泌治療復(fù)發(fā)或進展的HR+/HER2-晚期乳腺癌患者。
與歐美國家相比,我國CDK4/6抑制劑的臨床應(yīng)用相對滯后。作為中國首個自主研發(fā)的CDK4/6抑制劑,達爾西利將有力推動CDK4/6抑制劑的應(yīng)用可及性,令更多HR+/HER2-乳腺癌患者能夠從規(guī)范治療中獲益。
復(fù)星凱特生物科技有限公司 「中國細胞治療的開路先鋒 — 阿基侖賽注射液」 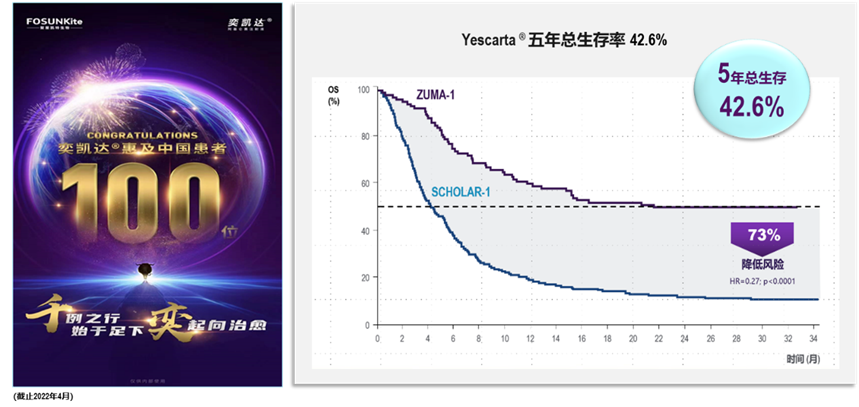
2021年6月,中國首個商業(yè)化CAR-T產(chǎn)品奕凱達?(阿基侖賽注射液)獲批上市,開創(chuàng)了中國細胞治療元年。阿基侖賽注射液是以CD19為靶點的自體CAR-T細胞療法。
其特色是: 在三線及以上大B細胞淋巴瘤患者中進行的注冊臨床研究ZUMA-1顯示:經(jīng)阿基侖賽治療的患者最佳客觀緩解率(ORR)為83%,完全緩解率(CR)為58%;5年總生存率(OS)為42.6%。與傳統(tǒng)療法相比(SCHOLAR-1研究:CR 7%, mOS 6.3個月),阿基侖賽極大的提高了患者的生存獲益,為患者帶來可預(yù)見的治愈。
除此之外,阿基侖賽在二線大B細胞淋巴瘤患者(ZUMA-7)和三線及以上惰性濾泡淋巴瘤患者(ZUMA-5)中,均帶來極為顯著的療效改善。基于此,F(xiàn)DA已批準阿基侖賽用于一線免疫化療后難治或12個月內(nèi)復(fù)發(fā)的DLBCL患者,和三線及以上的復(fù)發(fā)難治性濾泡性淋巴瘤患者。
針對個體化治療模式的痛點,復(fù)星凱特開創(chuàng)了自體CAR-T在中國商業(yè)模式的成功先例,進行了以下創(chuàng)新舉措:
1.醫(yī)院端:通過嚴格的質(zhì)量認證,建立規(guī)范的治療中心;設(shè)立CAR-T運營專員,提供患者的醫(yī)護服務(wù);并在非治療中心建立患者導流體系,擴大產(chǎn)品可及性。 2.支付端:攜手商業(yè)保險和TPA推出了多種創(chuàng)新支付/保險方案,包括:分階段付費、療效保險、積極納入省/市惠民保等,極大地降低患者的負擔,提高了支付意愿。 3.供給端:基于奕凱達?先進的生產(chǎn)工藝和全流程質(zhì)量管理,創(chuàng)新性地建立了端到端COI/COC鑒別與追溯系統(tǒng),并協(xié)助政府完善行業(yè)監(jiān)管,提升行業(yè)標準。?
奕凱達?商業(yè)化9個月內(nèi)惠及超過100名中國患者。中國真實世界的臨床療效與安全性達到甚至超過全球水平;生產(chǎn)和冷鏈物流均實現(xiàn)安全運營無重大偏差;并且奕凱達?已經(jīng)列入近30個省/市的城市惠民保與超過40項商業(yè)保險特藥目錄。開創(chuàng)了自體CAR-T在中國商業(yè)模式的成功先例。
燁輝醫(yī)藥科技(上海)有限公司 「治療慢性移植物抗宿主病(cGCHD)的藥物BN101」 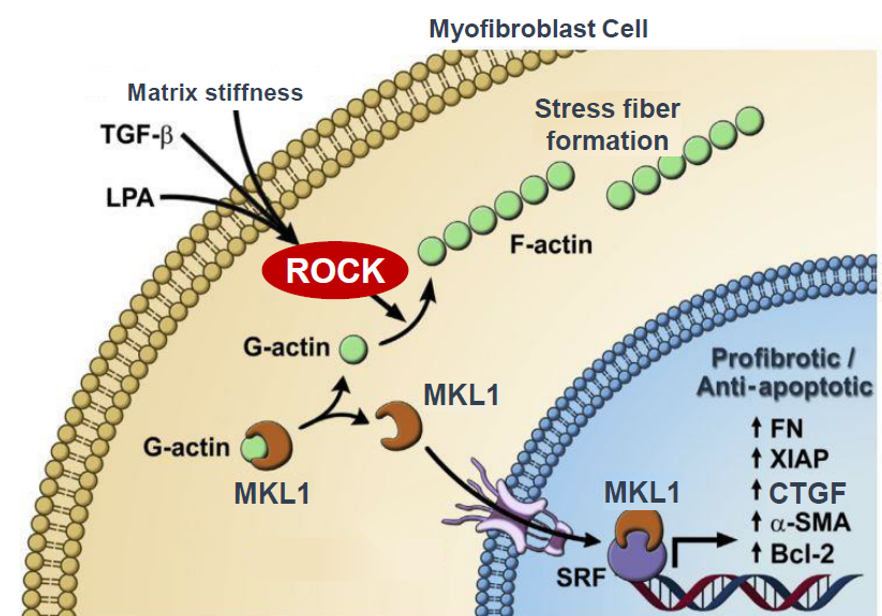 
慢性移植物抗宿主病(Chronic GVHD, cGVHD)是針對惡行血液腫瘤潛在治愈手段的異基因造血干細胞移植后常見的并發(fā)癥。
在cGVHD中,移植免疫細胞(移植物)攻擊患者的細胞(宿主),導致皮膚、口腔、眼睛、關(guān)節(jié)、肝臟、肺、食道和胃腸道等多個組織器官的炎癥和纖維化。在我國,目前每年有一萬例以上的異基因造血干細胞移植,移植后并發(fā)cGVHD的患者占30-70%。
產(chǎn)品REZUROCKTM / Belumosudil / KD025 / BN101(Belumosudil)是治療cGVHD的靶向藥物,于2021年7月被美國FDA獲批上市。該藥有潛力成為激素標準治療失敗后cGVHD的治療首選。
其作用機制為抑制Rho相關(guān)含卷曲螺旋蛋白激酶II抑制劑(ROCK2 inhibitor),起到抗炎抗纖維化的療效,適用于治療既往至少2線系統(tǒng)性治療失敗的成人和12歲及以上兒童cGVHD患者。燁輝醫(yī)藥擁有belumosudil的中國權(quán)限,已完成了新藥申報,等待獲批上市。
浙江時邁藥業(yè)有限公司 「源頭創(chuàng)新開發(fā)技術(shù)平臺 & 單/雙靶向抗體藥物」  
時邁藥業(yè)是一家進入臨床階段的創(chuàng)新型生物制藥企業(yè),致力于開發(fā)治療惡性腫瘤和自身免疫性疾病靶向抗體藥物,以美國研發(fā)中心為龍頭,杭州基地為依托,建立了完善的創(chuàng)新生物醫(yī)藥研發(fā)體系,自主開發(fā)了多個具全球競爭力的抗體藥物開發(fā)技術(shù)平臺:4個超大容量的IgM的抗體文庫和高通量快速免疫文庫抗體發(fā)現(xiàn)平臺、2個完全自主知識產(chǎn)權(quán)的HBiBody和proBibody雙特異性抗體平臺及前瞻性抗體藥物適應(yīng)癥動物篩選體系。
憑借完全自主知識產(chǎn)權(quán)的前沿核心技術(shù)平臺,開發(fā)出一系列First-In-Class單/雙抗源頭創(chuàng)新產(chǎn)品,靶向多種實體瘤、血液瘤及免疫性疾病,所有產(chǎn)品管線序列和分子設(shè)計均來源于公司自主研發(fā)的抗體文庫和雙抗平臺,這些功能差異性產(chǎn)品可解決現(xiàn)有臨床的痛點,避免與其他公司的同質(zhì)化競爭。
公司的商業(yè)模式是以完全創(chuàng)新藥物為先導,終端產(chǎn)品開發(fā)與階段性中期產(chǎn)品轉(zhuǎn)讓,技術(shù)平臺授權(quán)應(yīng)用或轉(zhuǎn)讓相結(jié)合,并可依托自身的核心競爭力,在滿足自身產(chǎn)品管線開發(fā)的同時,也可為國內(nèi)外其他制藥企業(yè)提供豐富的產(chǎn)品輸出,從而促進生物制藥產(chǎn)業(yè)的蓬勃發(fā)展。
浙江霍德生物工程有限公司 「iPSC細胞治療產(chǎn)品開發(fā)平臺」  
浙江霍德生物工程有限公司擁有領(lǐng)先的iPSC重編程、多種定向分化細胞工程、以及iPSC基因編輯等技術(shù)優(yōu)勢,已獲得多項自主知識產(chǎn)權(quán)和PCT保護。公司建立的GMP iPSC細胞株和細胞庫可用于商業(yè)授權(quán)及境外申報,所建立的多種臨床級iPSC衍生細胞規(guī)模化生產(chǎn)(包括神經(jīng)、眼科、免疫細胞等)的研發(fā)平臺和質(zhì)量標準處于行業(yè)領(lǐng)先水平。
公司擁有全球領(lǐng)先的IPSC細胞治療產(chǎn)品開發(fā)平臺,以神經(jīng)細胞為例,在約翰霍普金斯第一代RONA方法的基礎(chǔ)上,公司自主研發(fā)的二代RONA神經(jīng)細胞分化技術(shù)和臨床級生產(chǎn)工藝,實現(xiàn)批量、穩(wěn)定分化iPSC至高純度的各種神經(jīng)前體細胞,在體內(nèi)外可快速分化為與人大腦的組成和功能非常接近的多種神經(jīng)細胞。目前神經(jīng)在研管線有:
(1)前腦神經(jīng)前體細胞治療產(chǎn)品hNPC01,主要針對前腦損傷引發(fā)的神經(jīng)疾病,適應(yīng)癥為缺血性腦卒中的偏癱穩(wěn)定期后遺癥,以及腦溢血、顱腦損傷等引起的后遺癥; (2)脊髓運動神經(jīng)前體細胞產(chǎn)品hNPC02,針對脊髓損傷、漸凍癥等疾病; (3)中腦神經(jīng)前體細胞產(chǎn)品hNPC03,針對帕金森氏病; (4)前腦神經(jīng)前體細胞分泌的外泌體hNPC-EX,針對自閉癥、阿爾茨海默氏病等。 其中hNPC01產(chǎn)品,預(yù)計將于2022年進行中美IND雙報,目前是全球第一款針對腦卒中的iPSC衍生神經(jīng)前體細胞產(chǎn)品。
浙江澳嵐丁生物科技有限公司 「基于微生物發(fā)現(xiàn)及生物合成平臺的抗瘧疾藥物」 
通過“AI+基因分析”從微生物真菌中開發(fā)各種用途基因編碼小分子和生物酶,并進行大規(guī)模生物合成。通過高通量微生物學、AI機器學習、基因組工程等技術(shù)在真菌中搜索具有預(yù)定目標和生物學功能的新型基因編碼小分子。與最先進的生物合成結(jié)合,推動產(chǎn)品規(guī)模化開發(fā)。
2022年全球防瘧投入超過60億美金。世界上每年有2億多人患瘧疾,約100萬人死于瘧疾。通過大數(shù)據(jù)和基因相關(guān)性分析,團隊發(fā)現(xiàn)了瘧疾在蚊子中感染的關(guān)鍵蛋白FREP1,并闡明了它的分子機理。針對該蛋白創(chuàng)立了新型高通量篩選方法,發(fā)表了世界上首個可以直接抑制蚊子體內(nèi)瘧原蟲的天然產(chǎn)物-普利辛。
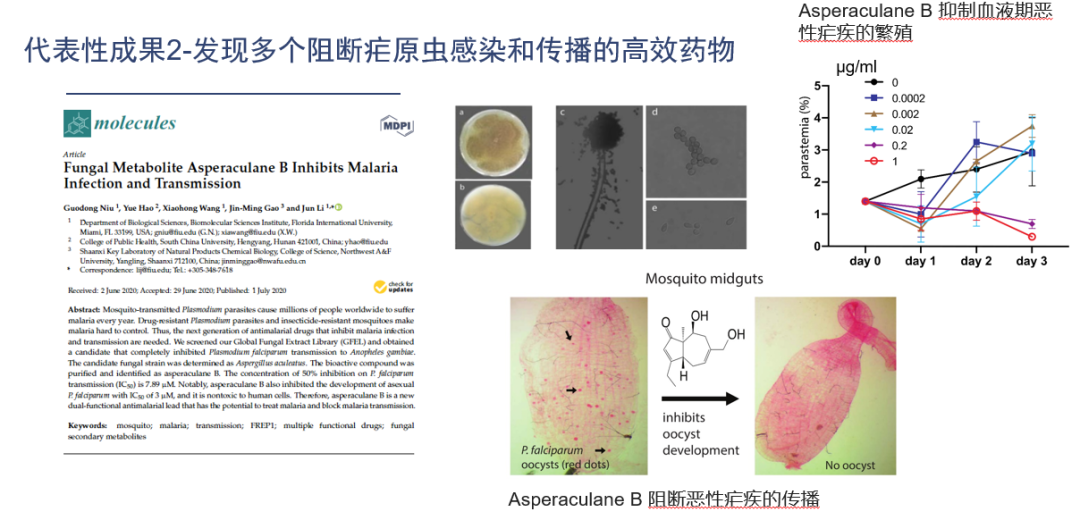
在世界上首個提出并證明通過使用天然產(chǎn)物噴灑至皮膚或環(huán)境就可直接抑制瘧原蟲在人和蚊蟲兩個宿主中繁殖,從而達到預(yù)防、治療和阻斷瘧疾傳播。普利辛的實驗效果證明其對瘧原蟲LD50(半致死濃度)為0.2nM, LD95(95% 致死濃度)為1nM, 遠遠低于市場上的上一代抗瘧藥包括氯喹(chloroquine)和乙胺嘧啶(pyrimethamine)和新一代抗瘧藥青蒿素的各類延伸物例如青蒿琥酯(artesunate), 也低于一些世界衛(wèi)生組織公布的正在進行臨床實驗的新藥的濃度包括MK4815、 Mefloquine、RKA182等LD50=2mM)和乙胺嘧啶和青蒿素。
藥物牧場(上海藥苑/浙江藥苑生物科技有限公司) 「IDinVivo+疾病靶點發(fā)現(xiàn)平臺,Medchem5藥物化學AI設(shè)計平臺」  
藥物牧場成立于2015年,是致力于全球首創(chuàng)(first-in-class)新藥研發(fā)的生物科技公司。聚焦于乙肝、腫瘤、自身免疫及炎癥代謝等治療領(lǐng)域。
其特色是: 基于PiggyBac轉(zhuǎn)座子技術(shù)的IDInVivo+藥物靶點發(fā)現(xiàn)平臺和Medchem5藥物化學AI設(shè)計平臺。已成功建立高效的創(chuàng)新靶點和新藥發(fā)現(xiàn)平臺,實現(xiàn)了具有完全自主知識產(chǎn)權(quán)的全球首創(chuàng) (first-in-class)新藥開發(fā)。
IDInVivo+平臺所采用的piggyBac轉(zhuǎn)座子技術(shù)是一種可實現(xiàn)在免疫健全小鼠體內(nèi)進行全基因組隨機基因敲除或激活的基因編輯技術(shù)。
根據(jù)正向遺傳學方法先找到抑制疾病的突變小鼠,再確定該突變小鼠的基因突變,能夠高效準確開發(fā)藥物靶點。目前藥物牧場基于此開發(fā)出多個靶點,其中一個靶點已進入I期臨床試驗階段。
該案例也是中國本土企業(yè)從發(fā)現(xiàn)全新靶點到獲批臨床的第一例。Medchem5藥物化學設(shè)計平臺利用新型圖卷積神經(jīng)網(wǎng)絡(luò)預(yù)測化合物結(jié)構(gòu)和活性關(guān)系,新型對抗生成深度學習神經(jīng)網(wǎng)絡(luò)生成全新化合物結(jié)構(gòu)式,新型強化學習神經(jīng)網(wǎng)絡(luò)藥物化學決策AI,自動完成藥物設(shè)計和資源分配。該平臺亦是真正具有實用性的AI藥物設(shè)計和發(fā)現(xiàn)手段。
該平臺在2021年4月的藥物設(shè)計測試中擊敗了5位人類藥物化學家,后又在18個月內(nèi)開發(fā)出一款全球首創(chuàng)新藥,較傳統(tǒng)方法縮短了50%的開發(fā)時間。
南京艾爾普再生醫(yī)學科技有限公司 「iPS諾獎技術(shù)重磅應(yīng)用——同種異體人源再生心肌細胞技術(shù)填補全球中重度心衰治療市場空白」  
「iPS諾獎技術(shù)重磅應(yīng)用——同種異體人源再生心肌細胞技術(shù)填補全球中重度心衰治療市場空白」
心血管疾病是全球首位致死疾病,也是我國第一大疾病病種。就中重度心衰(III到IV級)而言,目前除心臟移植外,尚無其他有效治療措施和技術(shù)。據(jù)統(tǒng)計,我國需要心臟移植的終末心衰患者數(shù)約為40-50萬,而每年心臟移植手術(shù)僅有600例左右,在長期無心臟供體的窘境下,數(shù)十萬患者無有效治療,其兩年生存期大約為50%。
基于此,作為中國難治疾病iPS細胞模型庫標準化建設(shè)者,秉承“讓人類健康的活到120歲”愿景的艾爾普再生醫(yī)學直面臨床難題,為解決心臟系統(tǒng)退行性疾病積極探索前沿有效治療技術(shù)。誘導多能干細胞(iPSC)的出現(xiàn)打破終末期心衰患者只能通過心臟移植挽救生命的現(xiàn)狀,其再生的心肌細胞具備低免疫原性,且與天然心肌細胞有相似的電生理特性,更容易與宿主心臟進行整合。
作為全球領(lǐng)先的基于iPSC創(chuàng)新治療技術(shù)的探索者,艾爾普再生醫(yī)學潛心開發(fā)通用型細胞藥物,其中用于中重度心衰的細胞治療項目已取得國內(nèi)首個國家衛(wèi)健委基于iPSC技術(shù)的臨床研究備案資質(zhì),并已進入全國多個權(quán)威臨床醫(yī)學中心。
艾爾普再生醫(yī)學始終踐行“Live Better&Longer”,努力為臨床患者提供安全且可負擔的創(chuàng)新型細胞治療產(chǎn)品,為“讓人類健康的活到120歲”貢獻力量!
信念醫(yī)藥科技(上海)有限公司 「基于AAV載體的血友病基因治療藥物」 
信念醫(yī)藥自主研發(fā)的BBM-H901注射液是以重組腺相關(guān)病毒(rAAV)為載體的血友病B基因治療藥物,采用了擁有完全自主知識產(chǎn)權(quán)的肝靶向性血清型和高效基因表達盒,運用了自主開發(fā)的、全球領(lǐng)先的大規(guī)模無血清懸浮培養(yǎng)和層析工藝技術(shù)。
與傳統(tǒng)藥物相比,這種血友病基因療法打破了血漿原料限制,不依賴于血漿原料,沒有血漿供應(yīng)不足的風險。患者治療成本也大幅下降,治療費用從每周數(shù)次針劑,變?yōu)榻K生只需一次性注射或數(shù)年一次,總治療費用大大降低。與國外研發(fā)的同類競品相比,該產(chǎn)品更加安全低毒,適用人群更廣,藥物生產(chǎn)成本更低。
本產(chǎn)品自2019年就開始研究者發(fā)起的臨床研究,目前已完成臨床單次給藥后最長2年多的患者隨訪,并且已經(jīng)進入注冊臨床階段。目前臨床研究中的患者臨床療效及安全數(shù)據(jù)均良好,同時整體臨床研究結(jié)果已于2022年5月發(fā)表于國際血液學權(quán)威期刊《柳葉刀-血液病學》(The Lancet Haematology)。
本產(chǎn)品是國內(nèi)第一個進入注冊臨床試驗階段的血友病AAV基因治療藥物,也是中國乃至亞洲第一個靜脈給藥的罕見病基因治療藥物。
西湖生物醫(yī)藥科技(杭州)有限公司 「工程化紅細胞治療藥物」 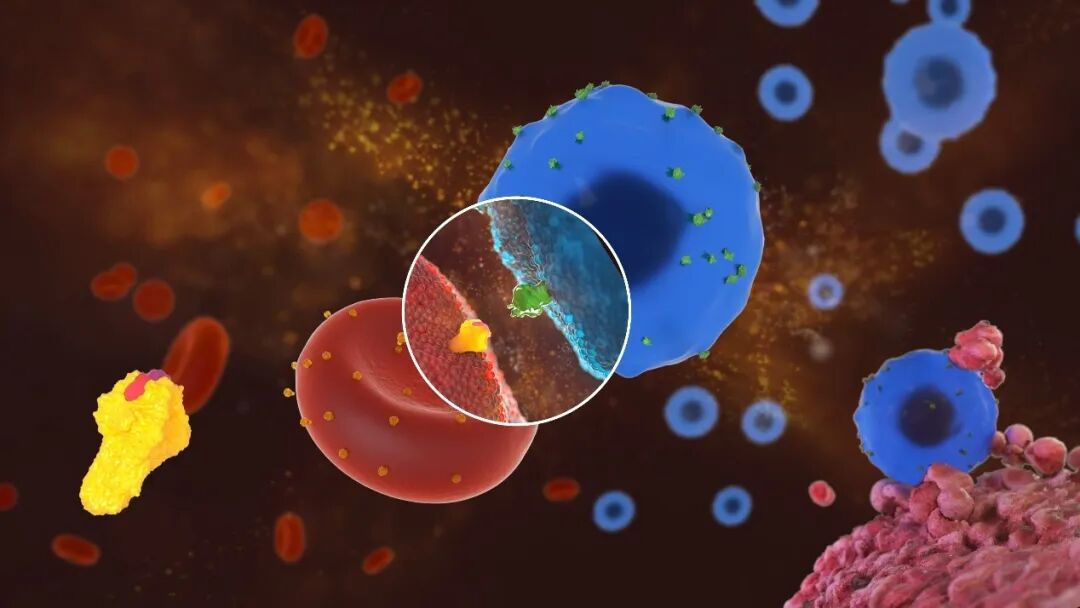
近年來,細胞技術(shù)在多種難治性疾病的臨床研究上獲得了許多成績,以細胞治療為核心的替代或再生治療為束手無策的、嚴重危害人類健康的各種慢性或退行性疾病的治療與康復(fù)帶來了希望。
紅細胞作為一種新型細胞療法,不同于其他免疫細胞療法,其在安全性上展現(xiàn)了獨有的優(yōu)勢。利用造血干細胞和基因編輯技術(shù)“創(chuàng)造新的紅細胞”是近年科學家們開發(fā)的新技術(shù)并且發(fā)展迅速。
西湖生物醫(yī)藥的技術(shù)平臺REDx是國內(nèi)首個紅細胞藥物技術(shù)平臺,完全自主開發(fā)了成體紅細胞直接負載藥物的平臺。
其特色是: 1、思路的創(chuàng)新。項目通過基因工程手段打造治療型紅細胞平臺。以工程化紅細胞為藥物載體進行腫瘤的治療,這在國內(nèi),尚屬首次。
2、技術(shù)的創(chuàng)新。研發(fā)的新技術(shù)極大地提升了在紅細胞表面的蛋白表達量,使得每次僅需輸入少量治療型紅細胞即可產(chǎn)生明顯生物學功能。同時,工程化紅細胞會被自動清除,不存在滯留情況,降低了副作用。
3、實用性的創(chuàng)新。項目開發(fā)的基于外周血進行紅系誘導分化培養(yǎng)技術(shù)彌補了臍帶血或骨髓取材困難的缺點,具有更好的實用性。
4、市場差異化策略的創(chuàng)新。公司的紅細胞治療產(chǎn)品技術(shù)作為國內(nèi)唯一一個從事紅細胞研究的前沿技術(shù),在市場方面擁有著強大競爭力。公司擁有兩條紅細胞藥物搭載制備技術(shù)路線,即:通過造血干細胞構(gòu)建紅細胞藥物載體,以及利用成熟紅細胞直接進行藥物搭載。
5、工藝開發(fā)的創(chuàng)新。紅細胞的規(guī)模化生產(chǎn)要求有一系列的工藝開發(fā)過程,能夠第一個摸索并被開發(fā)出的適用工藝將有極大機會成為該行業(yè)的標準,而西湖生物就是工程化紅細胞規(guī)模化生產(chǎn)這項工藝開發(fā)領(lǐng)域的先行者。
西湖生物作為西湖大學成功孵化的第一家轉(zhuǎn)化落地公司,經(jīng)過兩年多的發(fā)展,擁有針對癌癥、免疫與代謝等重大疾病的多個first-in-class細胞藥物研發(fā)管線。通過改造成熟紅細胞與干細胞來源紅細胞,可以生產(chǎn)多種用于治療與診斷的細胞產(chǎn)品。同時,開放的紅細胞工程化技術(shù)平臺,能夠高效攜帶多種類型藥物并在體內(nèi)靶向與長期作用。
西湖制藥(杭州)有限公司 「靶向冠狀病毒核心蛋白酶非共價小分子抑制劑藥物研發(fā)」
2020年初疫情爆發(fā)以來,西湖大學快速響應(yīng)國家號召,以生命科學學院院長于洪濤教授領(lǐng)銜,聯(lián)合王廷亮、胡奇、黃晶教授等團隊,集結(jié)了一支涵蓋生物化學、細胞生物學、結(jié)構(gòu)生物學、AI輔助藥物設(shè)計、藥物化學、安評毒理等多學科聯(lián)合攻關(guān)隊伍,聚焦靶向新冠病毒關(guān)鍵核心酶3CLpro開展原創(chuàng)小分子藥物開發(fā)。
其特色是: 采用國際前沿的DNA編碼化合物庫篩選策略,結(jié)合端到端計算模擬和藥效關(guān)系學等跨學科人工智能藥物研發(fā)平臺的優(yōu)勢,通過分子設(shè)計-藥物合成-藥物優(yōu)化-功能驗證協(xié)同創(chuàng)新體系,經(jīng)過兩年的不懈努力,項目團隊獲得了全新結(jié)構(gòu)、機制新穎、藥效顯著、安全性高的非共價抑制劑藥物分子,對于包括新冠病毒(COVID-19)、嚴重急性呼吸道綜合征(SARS)和中東呼吸綜合征(MERS)冠狀病毒等均具有廣譜抑制作用,從細胞到動物體內(nèi)測試,在安全性及抗病毒有效性上均表現(xiàn)出明顯優(yōu)勢。
目前,該藥物分子已完成包括藥代、藥動、藥效、藥劑、安全性評估等臨床前研究,依托西湖大學成果轉(zhuǎn)化公司西湖制藥,開展臨床IND申報,力爭于年內(nèi)完成臨床研究,將有望成為一款中國原創(chuàng)并擁有自主知識產(chǎn)權(quán)的抗新冠病毒口服小分子藥物,為實施我國全面預(yù)防和治療新冠病毒肺炎的戰(zhàn)略任務(wù)做出貢獻。
士澤生物醫(yī)藥(蘇州)有限公司 「人多能干細胞來源多巴胺能神經(jīng)前體細胞治療帕金森等神經(jīng)系統(tǒng)疾病的研發(fā)與產(chǎn)業(yè)化」

士澤生物致力于為帕金森病等一系列尚無臨床解決方案的重大疾病提供規(guī)模化、低成本的干細胞治療方案。人類多能干細胞具有在體外無限增殖和多向分化的潛能,不僅可用于疾病發(fā)生發(fā)展機理的研究以及體外藥物篩選,而且為細胞替代性治療人類重大疾病提供了新的可能。通過體外誘導分化人類多能干細胞制備功能性的細胞類型,用于細胞移植替代人體內(nèi)功能損傷或退化的細胞,有望利用細胞替代性治療手段解決人類重大疾病。
其特色是: 1、原理論證了小分子誘導神經(jīng)細胞直接重編程的可行性,解析了化學重編程的分子機理(Cell Stem Cell(IF=24.6)2015年封面論文)。
2、基于重編程過程的中間態(tài)建立了全新的譜系重編程方法、大量制備不同類型的功能細胞(Cell Stem Cell 2017年度最佳論文);受到了Nature、Science、F1000等國際權(quán)威雜志和學術(shù)媒體的報道和推薦。
3、鑒定了膠質(zhì)細胞命運決定的關(guān)鍵因子,建立了向不同亞型特化的膠質(zhì)細胞的高效誘導分化方法(被評論為“了解人類大腦及其進化的重要一步”)。
目前,士澤生物已建立了快速、高效、穩(wěn)定的iPS細胞株重編程、基因編輯及iPSC誘導分化等關(guān)鍵技術(shù)平臺,擁有細胞藥物安全性和有效性評價的關(guān)鍵動物模型;以多能干細胞分化為功能神經(jīng)細胞治療帕金森病為代表的等多條研發(fā)管線正快速、積極推進。
在李翔博士的帶領(lǐng)下,士澤生物已自主設(shè)計并建設(shè)完成1600㎡研發(fā)中心和正建設(shè)3500㎡生產(chǎn)轉(zhuǎn)化基地,士澤生物團隊已完成iPS細胞株重編程、iPSC基因編輯平臺和iPSC向不同亞型神經(jīng)細胞誘導分化等關(guān)鍵技術(shù)平臺的建設(shè),建設(shè)完成細胞藥物安全性和有效性評價的帕金森病動物模型,并布局了相關(guān)專利,所建立的iPSC研發(fā)平臺和質(zhì)量標準處于行業(yè)領(lǐng)先水平。
上海盟科藥業(yè)股份有限公司 「1類抗耐藥菌新藥康替唑胺」
全球原創(chuàng)抗耐藥菌新藥優(yōu)喜泰?(康替唑胺片)是由上海盟科藥業(yè)股份有限公司自主設(shè)計和開發(fā)的新一代噁唑烷酮類抗菌藥,可用于治療多重耐藥革蘭陽性菌引起的感染。
自從2008年,由盟科科學家設(shè)計和發(fā)現(xiàn)以來,康替唑胺片已完成了中國I、II和III期臨床試驗,澳大利亞I期及美國II期臨床試驗,成功于2021年6月通過國家藥品監(jiān)督管理局優(yōu)先審評審批程序批準上市,首個適應(yīng)癥為復(fù)雜性皮膚和軟組織感染,并于2021年12月通過國家醫(yī)保談判納入2021年國家醫(yī)保目錄。
注射用MRX-4為基于康替唑胺前藥開發(fā)的注射制劑,已完成美國II期和中國I期臨床試驗,并已在近期啟動注射用MRX-4序貫康替唑胺片的全球多中心III期臨床試驗,以支持注射用MRX-4和康替唑胺片未來在全球主要市場的上市申請。
其特色是: 1、對多重耐藥革蘭陽性菌有出色的抗菌活性。 2、臨床試驗未見骨髓抑制趨勢,安全性好。 3、藥物-藥物相互作用的風險低。
盟科是一家以治療感染性疾病為核心,擁有全球自主知識產(chǎn)權(quán)和國際競爭力的創(chuàng)新藥企業(yè),聚焦全球日益嚴重的細菌耐藥性問題,以“解決臨床難題、差異化創(chuàng)新”為核心競爭力,目標為臨床最常見和最嚴重的耐藥菌感染提供更有效和更安全的治療選擇。
上海誠益生物科技有限公司 「代謝及免疫疾病小分子新療法」  
免疫及代謝系統(tǒng)是人類健康生活的基石,不僅抵御外界入侵,而且維持自身機體的免疫代謝平衡,因此很多疾病都源于免疫及代謝系統(tǒng)的失衡。誠益生物以全球領(lǐng)先的視角建立的新穎和差異化的研發(fā)管線項目來解決代謝和免疫相關(guān)疾病未滿足的臨床需求。?
其特色是: 1)小分子GLP-1受體激動劑。目前市場上針對T2D和肥胖的GLP-1藥物,基本上都是注射制劑為主,價格昂貴且使用、保存不便。誠益小分子GLP-1受體激動劑在降血糖基礎(chǔ)上有顯著減重及潛在心血管獲益,更方便的口服方式、保存方式及更好的患者依從性,而且可支付性高。
2)肝特異性靶向的THR?激動劑。是具有能全面下調(diào)低密度膽固醇(LDL)、甘油三酯(TG)和脂蛋白(Lp(a))等血脂的小分子新藥,更有服藥方便、可支付性高、聯(lián)用性高等特點,在市場同類產(chǎn)品中優(yōu)勢明顯。
3)SSAO抑制劑。目前對骨關(guān)節(jié)炎的治療更側(cè)重于減輕關(guān)節(jié)疼痛,而抑制關(guān)節(jié)軟骨損傷、減少疾病進程的改善型新藥仍未批準上市。誠益產(chǎn)品在抑制炎癥、改善免疫代謝水平、減輕關(guān)節(jié)疼痛等方面都達到了遠高于上市藥物的效果。
4)針對于NASH(非酒精性脂肪肝炎)的新型口服小分子藥物(聯(lián)合用藥)。目前在全球主流市場上還沒有被批準治療NASH的藥物上市。誠益的多靶點GLP-1+THRb(NASH中前期)、SSAO(NASH中后期)聯(lián)合用藥,覆蓋NASH病癥全周期,有望緩解/治療NASH。
上海邦耀生物科技有限公司 「世界首例CRISPR基因編輯治療β0/β0型重度地貧患者,已擺脫輸血依賴」
“地貧”是指一種由珠蛋白基因缺失或點突變致使珠蛋白肽鏈合成被部分或完全抑制的遺傳性溶血性貧血疾病。這類單基因遺傳病是我國南方人口出生缺陷的重大公共衛(wèi)生問題之一。目前,全球地中海貧血基因攜帶者約1.8億,每年出生的各類重癥地貧患兒數(shù)至少20萬;據(jù)《中國地貧藍皮書》(2020)不完全統(tǒng)計,中國地中海貧血基因攜帶人數(shù)達3000萬,中間型和重型地中海貧血患者人數(shù)達30萬,且正以每年約10%的速度遞增。對于輕型的β地中海貧血一般無需治療,而中型和重型β地中海貧血一般的治療方法有輸血,鐵鰲合劑治療,脾切除及脾動脈栓塞,造血干細胞移植(hematopoietic stemcell transplantation, HSCT)等。其中,異基因造血干細胞移植(HSCT)是目前唯一可以根治β地中海貧血的方法,但費用昂貴,且配型極其困難。
如果可以將自體造血干細胞經(jīng)基因校正后回輸?shù)交颊唧w內(nèi),則可以解決造血干細胞來源不足及配型困難的問題,而CRISPR基因編輯技術(shù)的進展給這種治療策略提供了可能。
其特色是: CRISPR-Cas9基因編輯技術(shù)是通過人工設(shè)計的sgRNA(guide RNA)來識別目的基因組序列,并引導Cas9蛋白酶進行有效切割DNA雙鏈,從而進行基因敲除或敲入等,最終達到對基因組DNA進行編輯的目的。在利用基因編輯技術(shù)治療地貧的過程中,體外造血干細胞的基因編輯效率與移植的成功率和療效是直接相關(guān)的,只有編輯效率足夠高才有可能達到較高比例的重建,從而產(chǎn)生永久的治療效果。
目前,邦耀生物利用自主開發(fā)的基于基因編輯技術(shù)的造血干細胞平臺(ModiHSC?)在治療β0/β0型重度地貧患者的臨床試驗中已取得了良好的效果。自2020年7月以來,邦耀生物和中南大學湘雅醫(yī)院及中國人民解放軍聯(lián)勤保障部隊第九二三醫(yī)院合作,基因治療多例β地貧患者已治愈出院,且已擺脫輸血依賴,過上了健康人的生活。
其中湘雅的2例患者擺脫輸血依賴即將2年,這是亞洲首次通過基因編輯技術(shù)治療地貧,也是全世界首次通過CRISPR基因編輯技術(shù)治療β0/β0型重度地貧的成功案例。這一事件也代表了國內(nèi)基因編輯治療在臨床研究方面的突破性成果。值得一提的是,邦耀生物在地貧領(lǐng)域的突出性成果已選入到第二版《中國地貧防治藍皮書》(2020)的治療方法部分;并且就在2022年5月31日,邦耀生物的“BRL-101自體造血干祖細胞注射液”的臨床申請獲得國家藥監(jiān)局藥品審查中心(CDE)受理(受理號:CXSL2200236)。
相比其它β-地貧基因療法動輒上千萬,邦耀生物造血干細胞基因療法則更為高效、便捷和安全,具有靶向性好、安全性高、作用范圍廣、治療效果顯著等優(yōu)勢,可以做到一次治療終身治愈;并且成本可極大降低,有望成為更惠及大眾的療法。未來針對這一項目的研究對象年齡將進一步擴大到35歲,有望讓地貧移植領(lǐng)域的“老大難群體”——大齡及配型無望的患者受益。
邦耀生物作為一家以“以基因編輯引領(lǐng)創(chuàng)新,開發(fā)突破性療法,造福全人類”為使命的細胞基因藥企,不斷克服行業(yè)壁壘,進行多靶點的戰(zhàn)略布局,目前在基因編輯治療β-地中海貧血癥、PD1敲除非病毒定點整合CAR-T、以及UCART等項目中已經(jīng)取得優(yōu)異臨床效果。未來,仍將通過不斷地加速推進創(chuàng)新藥物的轉(zhuǎn)化與落地,從而造福包括地中海貧血在內(nèi)的全球罕見遺傳疾病及惡性腫瘤患者!
中山康方生物醫(yī)藥有限公司 「卡度尼利(PD-1/CTLA-4雙特異性抗體,研發(fā)代碼:AK104)」 
卡度尼利(PD-1/CTLA-4雙抗,AK104)是康方生物自主研發(fā)的新型的、首創(chuàng)的PD-1/CTLA-4雙特異性腫瘤免疫治療骨干藥物。已經(jīng)在中國、美國、澳洲開展了十余項單藥或聯(lián)合用藥的臨床研究,主要針對宮頸癌、胃癌、肺癌、肝癌、腎癌、鼻咽癌、實體瘤等大適應(yīng)癥。
其特色是: 1、利用其獨有的技術(shù)平臺“Tetrabody”研發(fā)的區(qū)別于PD-1單抗分子的四價(四結(jié)合表位)雙特異性抗體,具有更好的親和力和有效性。采用的IgG-ScFv結(jié)構(gòu),在保證具有腫瘤組織高留存的良好抗原差異化結(jié)合的基礎(chǔ)上,可快速介導獨立的PD-1或者CTLA-4內(nèi)吞;此外,IgG1骨架顯示了更穩(wěn)定的結(jié)構(gòu)特征,而引入了Fc段點突變,有效的消除了Fc段的效應(yīng)功能,為卡度尼利帶來了更好的安全性特征。
2、推動腫瘤免疫治療全面進入2.0時代:以PD-1為代表的免疫檢查點治療藥物開啟了腫瘤免疫治療1.0時代,卡度尼利作為同時靶向PD-1和CTLA-4兩個免疫檢查點分子,相比PD-1抑制劑或CTLA-4抑制劑單藥或聯(lián)合治療,具有更好的臨床療效,安全性與PD-1相當。目前,康方生物以卡度尼利作為免疫治療的“基石”產(chǎn)品,通過單藥或聯(lián)合用藥,實現(xiàn)同時2-4個靶點的治療效果,也可以聯(lián)合其他治療機制的藥物進行抗腫瘤治療。由此,卡度尼利將有力推動腫瘤免疫治療進入2.0時代,改寫治療格局。
3、有效性和安全性優(yōu)異,滿足臨床未被滿足的需求:臨床研究顯示卡度尼利2/3L治療轉(zhuǎn)移/復(fù)發(fā)性宮頸癌針對全人群(無論PD-L1表達情況)患者的ORR高達33%,CR高達12%,PD-L1陽性表達患者的ORR高達43.8%,CR高達17.2%。的療效數(shù)據(jù),遠高于全球已批準上市治療藥物或在研臨床研究的已披露數(shù)據(jù)。目前,卡度尼利已經(jīng)在中國提交2/3L治療轉(zhuǎn)移/復(fù)發(fā)性宮頸癌的上市申請,并獲得優(yōu)先審評,預(yù)計在2022年獲批上市。中國每年新增15萬宮頸癌患者,卡度尼利有望成為中國宮頸癌患者首款免疫治療藥物,填補臨床需求空白。
相關(guān)腫瘤的研究階段性數(shù)據(jù)顯示,卡度尼利單抗比PD-1聯(lián)合CTLA-4的聯(lián)合療法相比,毒性顯著降低,具有明顯的安全性和療效優(yōu)勢。基于卡度尼利單抗在復(fù)發(fā)/轉(zhuǎn)移宮頸癌臨床研究中獲得的積極效應(yīng),2021年9月,CDE已經(jīng)受理卡度尼利治療復(fù)發(fā)/轉(zhuǎn)移宮頸癌的新藥上市申請,并給予優(yōu)先審評資格。該藥物有望成為全球首款獲批的雙免疫檢查點抗體蛋白新藥,也將成為首款中國自主研發(fā)的創(chuàng)新雙特異性抗體藥物。
江蘇康寧杰瑞生物制藥有限公司 「新一代抗腫瘤藥物 PD-L1/CTLA-4 雙特異性抗體(依瑞利)的全球開發(fā)和產(chǎn)業(yè)化」
該項目由國家級重大人才引進工程入選者徐霆博士領(lǐng)銜研發(fā),目標產(chǎn)品依瑞利單抗(研發(fā)代號KN046)為PD-L1/CTLA-4 雙特異性抗體,是first-in-class類創(chuàng)新藥,在分子設(shè)計、臨床療效、安全性、工藝開發(fā)等多個方面取得重大突破,處于國際領(lǐng)先水平。
其特色是: 依瑞利單抗能同時識別人細胞程序性死亡-配體 1( PDL1)和人細胞毒性 T 細胞抗原 4( CTLA-4),有效阻斷 PD1 與 PD-L1 以及 CTLA-4 與 CD80/86 之間的相互作用,激活免疫系統(tǒng),防止腫瘤細胞逃逸,同時,還可通過清除Treg的負調(diào)控作用,增強針對腫瘤的免疫反應(yīng)。
依瑞利單抗屬于廣譜類抗腫瘤抗體藥,已針對多種發(fā)病較高的惡性腫瘤在中、美同步開展多項臨床試驗研究,其中依瑞利單抗聯(lián)合含鉑化療在晚期不可切除或轉(zhuǎn)移性鱗狀非小細胞肺癌患者中開展的Ⅲ期臨床研究已經(jīng)完成中期分析,正在進行BLA申報,有望成為我國針對大瘤種的首個上市的雙抗藥物。同時,依瑞利單抗用于PD-(L)1經(jīng)治晚期非小細胞肺癌、晚期胰腺癌等多項注冊臨床研究進展順利。
依瑞利單抗的制備工藝創(chuàng)新解決了多項培養(yǎng)基、填料、耗材等原/輔料國產(chǎn)化開發(fā)等“卡脖子”技術(shù),極大地降低了生產(chǎn)成本,為解決大分子藥物生產(chǎn)的瓶頸問題作出貢獻。
和黃醫(yī)藥(兩個創(chuàng)新項目) 
「蘇泰達?(索凡替尼膠囊):全球首個覆蓋所有部位來源神經(jīng)內(nèi)分泌瘤的中國創(chuàng)新靶向藥物」 
2020年12月,索凡替尼(商品名:蘇泰達?)獲國家藥品監(jiān)督管理局批準上市,用于治療非胰腺神經(jīng)內(nèi)分泌瘤。次年6月,其第二項用于治療胰腺神經(jīng)內(nèi)分泌瘤的適應(yīng)癥獲批,成為首個覆蓋所有來源的神經(jīng)內(nèi)分泌瘤的創(chuàng)新靶向藥物。這是和黃醫(yī)藥自主發(fā)現(xiàn)、研發(fā),完成在中國概念驗證試驗,第一個擴展到美國進行臨床研究的抗腫瘤藥物。
索凡替尼是一種新型的口服酪氨酸激酶抑制劑,兼有“抗血管生成”和“免疫調(diào)節(jié)”雙重活性,不僅抑制腫瘤新生血管生成,同時也可通過抑制CSF-1R來調(diào)控腫瘤微環(huán)境免疫應(yīng)答,激活人體自身的免疫系統(tǒng)來發(fā)揮抗瘤作用。其獲CSCO神經(jīng)內(nèi)分泌腫瘤診療指南(2021)最高證據(jù)級別1級推薦用于胰腺、胃腸道、肺或胸腺神經(jīng)內(nèi)分泌的治療。
索凡替尼的雙重活性,使其與其他免疫療法的聯(lián)合用藥有著與生俱來的優(yōu)勢。目前,和黃醫(yī)藥已達成了數(shù)個全球合作協(xié)議,以評估索凡替尼與PD-1單克隆抗體聯(lián)合療法的療效,包括替雷利珠單抗、特瑞普利單抗和信迪利單抗等。
隨著索凡替尼順利進入2022版國家醫(yī)保藥品目錄,以及其新適應(yīng)癥及聯(lián)合治療的探索進一步發(fā)展,其臨床價值、經(jīng)濟與社會效益將得到持續(xù)的提升。
歷經(jīng)十數(shù)載的研究,索凡替尼的出現(xiàn)為對于在全球范圍內(nèi)治療方法都十分有限的神經(jīng)內(nèi)分泌瘤,提供了全新的治療選擇,也向全球醫(yī)學界證明,中國創(chuàng)新藥正在崛起,為全球未盡滿足的醫(yī)療需求提供“中國方案”。
「沃瑞沙?(賽沃替尼片):中國首個選擇性MET抑制劑」
由和黃醫(yī)藥自主研發(fā)的賽沃替尼是一款強效、高選擇性的口服小分子MET抑制劑。歷經(jīng)十一年的研究證實,賽沃替尼在治療MET外顯子14跳躍突變的非小細胞肺癌方面展現(xiàn)了出色的抗腫瘤活性,同時也具有良好的耐受性。
2021年6月,賽沃替尼(商品名:沃瑞莎?)獲中國國家藥品監(jiān)督管理局有條件批準用于治療接受全身性治療后疾病進展或無法接受化療的間質(zhì)上皮轉(zhuǎn)化因子(“MET”)外顯子14跳躍突變的非小細胞肺癌患者。
2022年5月,上海滬惠保2022版發(fā)布,賽沃替尼作為特定高額藥品進入報銷清單。
目前,和黃醫(yī)藥正展開全球合作,繼續(xù)探索賽沃替尼作為單藥療法或與其他藥物的聯(lián)合療法,開發(fā)用于治療包括肺癌、腎癌和胃癌在內(nèi)的多種腫瘤類型,并在中國及海外展開多項注冊研究。
基于在中國人群臨床研究中取得的積極結(jié)果,賽沃替尼獲批上市,并列入2021版《中國臨床腫瘤學會(CSCO)非小細胞肺癌診療指南》II級推薦用藥,成為中國MET外顯子14跳躍突變患者的治療新選擇。
作為中國首個且唯一獲批應(yīng)用于此類患者的創(chuàng)新藥物,賽沃替尼不僅填補了國內(nèi)MET抑制劑的空白,并且有望成為首個代表中國走向全球的肺癌靶向創(chuàng)新藥物。
宜明昂科生物醫(yī)藥技術(shù)(上海)有限公司 「IMM01:新一代抗腫瘤藥物開發(fā)研究」 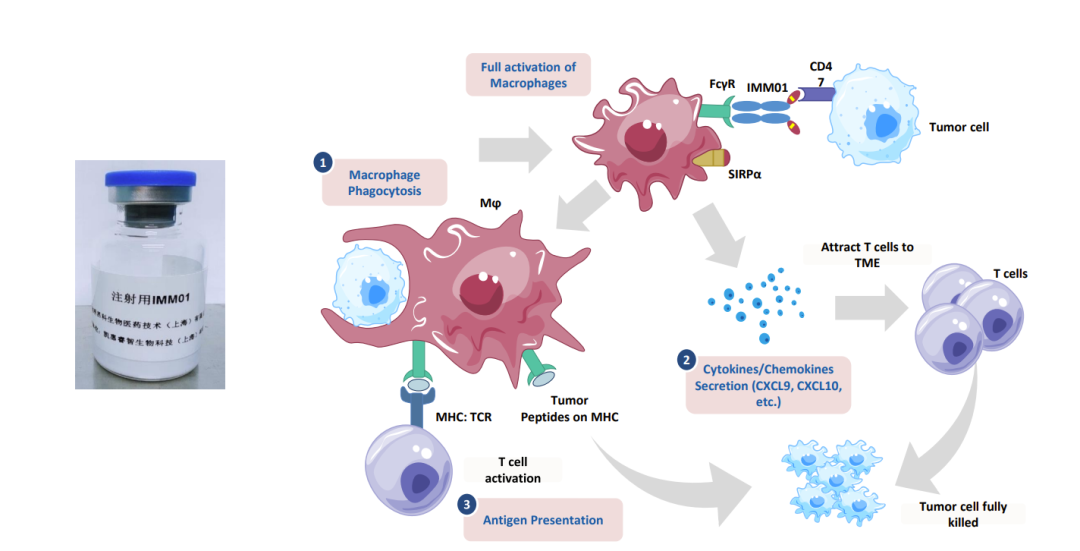
CD47靶點因其對多種腫瘤廣譜的作用機制,目前已成為業(yè)界繼PD-(L)1之后,最期待的下一個腫瘤免疫靶點,具有巨大的市場潛力。于2020年起,受到越來越多的業(yè)界關(guān)注,不少知名藥企不惜擲重金通過外部并購、產(chǎn)品授權(quán)引進的方式,對CD47靶點進行布局。
CD47雖然市場空間巨大,但針對該靶點的分子設(shè)計極具挑戰(zhàn)。很多知名藥企研發(fā)的CD47抗體,均因其抗體與人體紅細胞表達的CD47結(jié)合,產(chǎn)生很大的血毒性,而導致臨床的暫停或終止。
IMM01是基于宜明昂科技術(shù)平臺自有研發(fā)、經(jīng)基因改造的新一代靶向CD47的SIRPαFc融合蛋白,具有全球自主知識產(chǎn)權(quán)。
其特色是: 1、體外不與紅細胞結(jié)合,具有非常好的安全性。同時,分子設(shè)計上,采用了能夠通過“吃我”信號充分激活巨噬細胞,增強下游T細胞免疫反應(yīng)的IgG1 Fc。而全球大部分CD47抗體,因為其或多或少都會與人體紅細胞結(jié)合,故而只能使用Fc功能效應(yīng)較弱的IgG4 Fc,無法充分激活巨噬細胞。因此,我們與Trillium(被Pfizer并購)是全球范圍內(nèi)唯二的兩家在臨床上能夠看到針對復(fù)發(fā)耐藥淋巴瘤致使腫瘤完全緩解強大的單藥有效性,并兼具良好安全性的CD47分子研發(fā)企業(yè)。
2、具有強大的聯(lián)合用藥潛力,IMM01與阿扎胞苷聯(lián)用治療復(fù)發(fā)難治性急性髓樣白血病和骨髓增生異常綜合征的Ib/II期臨床研究,與PD-1抗體治療復(fù)發(fā)難治多種實體腫瘤的Ib/II期臨床研究,與三生國健合作治療HER2陽性實體瘤的Ib/II期臨床研究在同步推進,并在臨床前研究中展示出強大的抗腫瘤活性和良好的安全性。IMM01強大的單藥有效性也預(yù)期將使其聯(lián)合用藥顯示出比傳統(tǒng)CD47抗體更大的優(yōu)勢。
IMM01 聯(lián)合PD-1抗體的臨床前體內(nèi)藥效研究 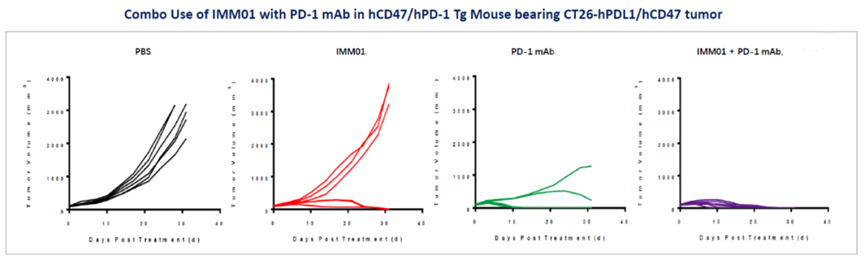
IMM01項目完美解決了CD47靶點藥物研發(fā)的核心痛點,與其它同靶點藥物相比具有較大的差異化優(yōu)勢,具有潛在全球“Best-In-Class”的藥物潛力。目前已分別在中國、日本和美國獲批發(fā)明專利。
注:近日,奇璞獎“入圍名單”公布后引起公眾廣泛關(guān)注,為了讓更多的民眾能夠及時、深入地了解健康行業(yè)的最新動態(tài),促進大眾接受并廣泛運用優(yōu)秀的創(chuàng)新成果,進而幫助優(yōu)質(zhì)的應(yīng)用落地。組委會接受入圍項目投稿,在奇璞微信公眾號上分批展示。(不分排名,投稿內(nèi)容會有微調(diào),滑動可查看更多項目信息)
第四屆奇璞獎致力構(gòu)建創(chuàng)新項目展示和交流合作的平臺,為推動醫(yī)療健康生態(tài)圈建設(shè)助力。歡迎醫(yī)健早期創(chuàng)新者踴躍申報「2022奇璞種子榜單」。 如涉及知識產(chǎn)權(quán)請與我司聯(lián)系 |