來源:奇點糕? 奇點網 ? ? ? ? ?? 發表時間:2019-2-13
2018年已經過去了一個多月了,這一年里醫學世界迎來了一系列重大進展,解決了很多以前未能解決的問題,但也留下了一些疑惑。
奇點君在這里總結了個人的2018年度十問,希望讀者們能夠跟著我們一起,思考未來世界該有的模樣。
免疫治療的春天來了嗎?
?春節過了,2019年的春天已經在路上了,這會同樣是免疫治療的春天嗎?
?這一問,想必讀者們也頗有感觸。2018年,國外PD-(L)1抑制劑終于登陸,國內企業緊隨其后,市場仿佛一夜之間進入戰國時代;而無論是藥物療效、既往困境的解決方案都有了比較大的進步;遑論,還有諾獎加身。
?3月,耶魯大學拿出了迄今為止最長時間的PD-1抑制劑臨床隨訪數據,晚期非小細胞肺癌五年生存僅有1-8%的歷史就此結束了。
不考慮藥物劑量,所有患者的5年生存達到了16%,其中3mg/kg組更是令人驚艷的26%。研究結果還顯示,PD-1抑制劑療效相當持久,部分患者雖然早期停藥,但響應卻是持續的。
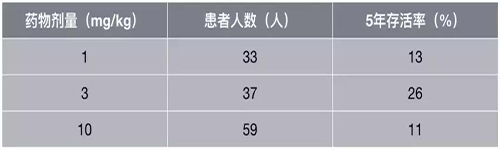
不同劑量的五年生存率數據
這已經足以說明,免疫治療正在改變癌癥治療的現狀。
?研究中還提到,患者的生存時間和PD-L1的表達水平是正相關的。這也是免疫治療之前一直沒能解決的問題,到底用什么指標來預測患者的免疫治療效果呢?
?最開始,科學家和醫生就是用PD-L1作為標準的,但是在實踐中這個觀點逐漸被否定了,有的研究里,就算PD-L1表達≥5%,免疫治療依舊不比標準化療更好。
?隨著研究的進行,一個新的答案浮出水面——腫瘤突變負荷(TMB)。目前來看,TMB可能就是最優解了。8月,科學家們首次證實,血漿TMB可以準確預測免疫治療的有效性,而且基于液體活檢技術,侵入性小、可重復性高,臨床潛力非常大。
?根據一系列臨床結果,2019版NCCN指南中,已經將TMB列為非小細胞肺癌患者接受免疫治療的推薦檢測方法。
當然了,TMB只是暫時的最優解,并不是最終解,依舊存在部分患者高TMB不響應、低TMB療效卻很好的情況,這說明未來還需要開發其他的生物標志物,聯合分析才是王道。

NCCN指南
那不響應的患者到底是為什么不響應?
?以前科學家一直認為,只要腫瘤中存在浸潤T細胞,那么我們只要激活他們就能夠阻擋腫瘤前進的腳步。誰能想到,腫瘤中干活的殺傷T細胞僅是少數,還有大量與癌癥無關的“旁觀者”T細胞呢?
另一項研究數據簡直觸目驚心。從研究中獲得的腸癌和乳腺癌數據來看,大約只有10%的腫瘤浸潤T細胞能夠識別腫瘤,其他的都是“旁觀者”。
?可見,T細胞狀態可能也得納入免疫治療效果評估的一環。實際上我們文章也提到過,2018年10月《科學》的一篇文章指出,同時檢測T細胞的活性水平和TMB應該是個不錯的方向。

?免疫檢查點抑制劑只是免疫治療的一小部分(也是最接近中國患者的一部分),除此之外,CAR-T也在ALL治療上拿下了優秀的成績,TCR-T、CAR-NK等新生力量開始嶄露頭角,溶瘤病毒、癌癥疫苗突破不斷,科學家甚至還想出了給CAR-T裝PD-1抗體這樣的黑科技。
?希望這春天能來得更猛烈一點。?
?他被忽視了嗎?
?2018年10月1日,舉世矚目的諾貝爾生理學或醫學獎揭曉。
結果公布,“免疫檢查點抑制癌癥療法”摘得桂冠,所有守在電腦前面看直播的中國觀眾先是一陣歡呼,又在看到獲獎人只有美國科學家James P. Allison和日本科學家本庶佑(Tasuku Honjo)時,驚掉了下巴。
幾乎所有人都在問,陳列平呢?
發出這個疑問的包括國內幾乎所有的專家、學者和媒體人。面對“諾獎又頒錯”的質疑,諾獎委員會的回應是,“在腫瘤免疫領域,做出重要貢獻的學者還有很多,但Allison和Honjo的貢獻從他們中脫穎而出”。
好,那我們就來看一看,到底都有哪些做出重要貢獻的學者,他們的貢獻又都是什么。
 ? ?
右邊這個空位,想把陳老師P上
James P. Allison主要是因CTLA-4獲諾獎的,但實際上CTLA-4最早是在1987年由法國科學家Pierre Golstein團隊克隆的,它的配體CD80則是百時美施貴寶的Peter Linsley團隊在1991年發現的,這兩個都跟Allison沒啥關系。
而阻斷CTLA-4和配體的結合,可以顯著增強免疫反應,則是芝加哥大學的Jeffrey A. Bluestone團隊發現的,也正是這一發現促使他們提出CTLA-4有免疫抑制功能。
直到這時,擔任加州大學伯克利分校癌癥研究實驗室主任的Allison才遲遲登場。
Allison迅速意識到,這一發現在癌癥治療中具有巨大價值。1996年,他率領團隊在動物實驗中證明,CTLA-4抗體可以增強免疫并治療動物腫瘤;2010年,CTLA-4抗體的首個III期臨床研究結果表明,該療法對晚期黑色素瘤有效。
不難看出,Allison的貢獻就在于將CTLA-4與癌癥治療聯系了起來。遺憾的是,CTLA-4的抗癌效果并不是非常好,免疫治療真正“爆紅”,還是因為PD-1/PD-L1。
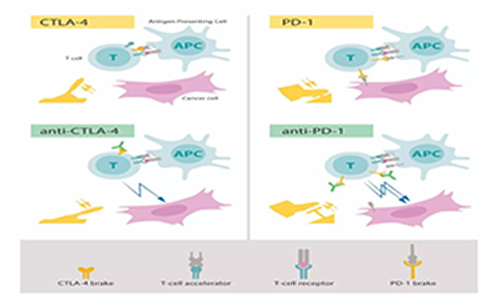
本庶佑在這里出場了。1992年,他所在的京都大學實驗室發現了PD-1,但在之后幾年里并沒怎么重視它,直到1999年才報告,敲除小鼠的PD-1會導致小鼠出現自身免疫疾病,并由此得出了PD-1可能有免疫抑制功能的結論。
同樣在1999年,在梅奧診所任職的陳列平實驗室首次報告了從人的正常細胞和腫瘤細胞中克隆到一個名為B7-H1的分子,該分子是第一個與腫瘤局部免疫反應抑制相關的分子,結合T細胞上的一個未知受體,能夠產生免疫抑制功能。
2000年,本庶實驗室與哈佛醫學院的Gordon Freeman合作,證實了PD-L1能夠與PD-1結合,從而抑制T細胞的增殖和細胞因子的分泌,負控淋巴細胞的激活。巧了,這個PD-L1,就是一年前陳列平實驗室發現的B7-H1。
2001年,Gordon Freeman率先報道了另一個PD-1的配體PD-L2,其功能和PD-L1類似。
2002年,陳列平團隊用單克隆抗體阻斷PD-L1和PD-1的結合,初步證明可以解除局部免疫抑制。這個研究第一次證明腫瘤可能會利用PD-L1抑制腫瘤免疫反應。
2010年,全球首個PD-1抗體臨床試驗結果發布,O藥從這里開始,陳列平在這個臨床研究中也發揮了重要作用。

陳列平
稍微理一下過去的事兒,不難看出,PD-L1是陳列平團隊首次克隆的,它在癌癥免疫中的作用也是陳列平團隊最早闡明的;除此之外,陳列平團隊還首次證明PD-L1抗體有抗腫瘤的作用;就算只論PD-1抗體的功能,陳列平團隊也是與本庶同時獨立證明的。
相信大家都有結論了。
要奇點君說,專業領域的獎還是請相關專業的人來評比較好。同道中人,每個人的貢獻多大,大家心里都跟明鏡兒似的。
獎項這個東西,說實話對科學家重要也不重要,畢竟寫在科學史上的不是那塊獎牌,而是實實在在做出的科研成就,有這么多人鳴不平、為陳老師叫屈,說明大家都已經記在心里了。
液體活檢能落地了嗎?
其實這個問題,第一問里就能回答一部分。當免疫治療走上主導,液體活檢很可能會成為標配,再加上越來越多的靶向藥,液體活檢的輔助診斷地位基本已經確定了。
我們自然是希望液體活檢能夠越來越好,比如,先把輔助這兩個字兒去了。

2018年,拿過兩次普利策獎的王牌記者John Carreyrou出了本新書。這本Bad Blood(《滴血成金》)一經出版,在全球范圍內引起了極大的轟動,一時間幾乎所有人都在談“滴血查病”。
人們真的太期待便捷的疾病檢測方法了,特別是百病之王癌癥,所以“滴血驗癌”謠言每年都有,人們每年都想信。(奇點君自己也很想信)
?遺憾的是,從技術層面上,“滴血驗癌”我們還實現不了,不過看了2018年的相關研究,誰都會認同我們離它越來越近了。

“滴血驗癌”的最大壁壘就是,要找到和癌癥關聯性足夠強的生物標志物,這標志物還不能數量太稀少,不然是做不到“滴血”的。
?2018年一開年,約翰霍普金斯大學的五位大牛就送上了一份大禮。這種名為CancerSeek的技術,能夠同時對八種常見癌癥進行早期檢測,特異性能達到99%以上,而且這八種癌癥有五種都還沒有早檢手段。
?也沒什么特別的(輕描淡寫.jpg),大牛們利用計算機模擬選出了16個癌癥相關突變和8個蛋白片段,對他們進行聯合檢測,在檢測數量和質量中間取了個最高性價比,所以這項技術最終落地也不會太貴,研究者估計成本大概在500美元左右。
?
“滴血驗癌”遲遲不能落地,另一個原因就是標志物太少了,比如說循環腫瘤細胞(CTCs)和循環腫瘤DNA(ctDNA),真的是,要多少,有多少,常規血檢的量根本測不出來什么。
?為了搞定這個問題,科學家們也是各出奇招。
?比如說哈佛的放射學大牛Sanjiv Gambhir就想到,給癌細胞標記上磁性納米粒子,然后用一根磁性金屬線直接伸入血管,就能把CTC釣起來,效率比抽血高出10-80倍。有點想管這個教授叫“哈佛萬磁王”哈哈。
?劍橋的科學家們則是發現了血液中循環腫瘤DNA和非腫瘤DNA片段的長度分布特征,以長度作為區分富集,可以提高ctDNA的豐度,同時保證檢測的靈敏性和準確性。實際使用這種方法來預測腫瘤進展,能夠比CT成像早60天,比未富集的活檢早89天,可以說是打開了液體活檢的封印了。
2018年尾巴液體活檢還刷了一波屏,鬧得科學家趕緊出來解釋技術離臨床應用還遠。不過十分鐘檢測幾乎所有癌種,是真的很爆炸很黑科技了,不怪媒體們這么激動。
?這套技術基于腫瘤組織或血液DNA的甲基化狀況,只需要1pg DNA就能檢測,并且配合了一種膠體金顏色指示劑,可以說是簡單方便物美價廉了。不過它的缺點就是沒法辨別癌種,可以作為篩查手段配合其他診斷。
?期望這些“概念機”能夠趕緊量產,讓“滴血驗癌”成真吧,再也不想辟這個謠了。
AI 會取代病理科醫生嗎?
?2018年才討論這個問題,顯得我們好像有些跟不上時代,畢竟“人工智能顛覆醫療”最熱鬧的一年其實是2017年了。
?當時斯坦福科學家用13萬皮膚病變圖片訓練了谷歌的AI算法,和21位皮膚科醫生進行了一場大比拼。卷積神經網絡確實牛,在識別常見癌癥和皮膚癌這兩項任務上,都達到了專家水平。

上了《自然》的封面
國內外媒體報道之后,給人的感覺就是AI閱片已經不遠了,除了擔心失業的病理科醫生們有點瑟瑟發抖,大多數人都很興奮,國內涌現了一大批基于人工智能的醫療創業公司, 背后全都是令人眼紅的資本。
?澎湃了一年,大家明顯淡定多了,很少有人談論人工智能會取代醫生,而是開始探索讓AI成為醫生們好助手的可能性。
?2018年,AI第一次爆炸來自華人科學家張康。張教授團隊開發的AI系統基于開源機器學習平臺TensorFlow,植入Inception-v3算法,輸入10萬張準確標注的OCT(光學相干斷層成像術)圖像,診斷眼疾準確性達到96.6%,靈敏性97.8%。
?比較厲害的是,這個系統經過遷移學習,可以輕松變身診斷肺炎的平臺。在區分肺炎和健康狀態時,準確性達到92.8%;即使是用來區分細菌性肺炎和病毒性肺炎,準確性也能達到90.7%。
?在世界范圍內,使用如此龐大的、標注好的高質量數據進行遷移學習并取得高度精確的診斷結果,得到與人類醫生相似甚至更高的準確性,在世界上還是第一次。
《細胞》封面推薦
第二炸規模更大,點火者是來自全球100多個實驗室的近150位科學家。他們開發了一個超級AI系統,基于腫瘤組織DNA的甲基化數據,可以準確區分近100種不同的中樞神經系統腫瘤。這個AI系統還能發現一些指南里面沒有的新分類,對于癌癥的精準治療,又是個巨大的進步。
?第三炸最驚奇。紐約大學學者利用大量數字化病理切片圖像重新訓練Inception V3,識別癌組織和正常組織準確率達到99%,區分腺癌和鱗癌的準確率達到97%,遠超前人研究;不僅如此,該算法竟然能夠從切片圖像中識別肺癌常見六大基因突變,包括已有靶向療法的EGFR突變,準確率能達到73%-86%。
?這樣看來,那塊小小的病理切片中也還有著更多秘密可挖掘啊。
?
還有一點值得一提的是,AI也涉足免疫治療領域了,而且可能可以解決一個困擾醫生和科學家很久的大問題。
?法國科學家開發了一個基于患者CT圖像的AI系統,可以準確預測PD-1抑制劑治療效果。該系統“欽定”有效的患者中位生存比預測無效的患者長了一倍以上(24.3個月 vs 11.5個月),效果相當明顯。
?不難看出,AI已經能完成相當一部分醫學任務,幫助醫生做決策了。難得的是,培養一個“火眼金睛”的頂級醫生很難,擁有一個專家水準的AI“助手”卻相對容易。
我們常看到各種頂尖的醫學進展,但是從全世界范圍來看,專業、高質量(甚至只是合格)的醫療資源在哪里都是稀缺的。就算在相對發達的城市,龐大的患者基數也會讓專科醫生供不應求,?大量病人不能及時轉診就醫,從而延誤就診治療的最佳時機。
AI能做的很多。診前疾病預防、篩查;診中輔助診斷、結果分析、輔助手術;診后隨訪、慢性病監測、康復協助、健康管理;乃至在輔助科研、藥物研發、基因篩選、醫療培訓等方面,AI都會帶來革命性的變革。
你能想到未來的模樣嗎?
 ? ?
腸道微生物過氣了嗎?
?敲下這個小標題的時候,奇點君不由得笑了,過年之際談起這個話題,還頗有一點辭舊迎新的感覺。
奇點幾乎是看著腸道微生物成為一代“網紅”的,每每發出相關研究,很容易收到讀者的各種“腸道菌要統治世界”了的驚呼。不過再驚奇,驚奇多了也就司空見慣。2018年,看到稍微普通一些的腸道微生物選題,連奇點糕們自己也很容易覺得,“哎,腸道微生物,想想也挺正常”。
?腸道微生物過氣了嗎?
?還沒。至少,目前攻克癌癥最有希望的免疫療法,還是得看腸道微生物的臉色。
?2018年第一周,《科學》雜志連發三篇論文,證實腸道微生物在免疫檢查點抑制劑治療中起著決定性作用,再加上之前發表的兩篇,可以說是坐實了患者對免疫療法的響應、預后都得看腸道微生物。

?《科學》封面
2015年,兩個研究小組分別在小鼠中發現,CTLA-1和PD-L1抑制劑療效竟然受到特定菌群的影響。這個震動腸道微生物和腫瘤兩界的發現,又經過了兩年的發酵,終于落下了人類患者中的實錘。
?接受同樣的PD-1抑制劑治療,服用抗生素的癌癥患者總體生存期(OS)竟然縮短了近45%!另兩組研究者也分別鑒定出了具體的菌屬。
?這項發現對兩個領域都不可謂不重大。腸道微生物宇宙邊界再一次擴大,腫瘤免疫治療也可能因此而再上一階——如果有能增強免疫療法的“便便膠囊”,吃吃又何妨呢?
其實不光影響免疫治療效果,在腫瘤的生長過程中,腸道菌也沒缺位,胰腺癌和結直腸癌這兩種癌癥都各自找到了一大群相關菌屬。
?既然它們愿意摻和,那咱們大可以利用一下。值得驕傲的是,首個基于腸道微生物的肝癌早診AI模型,還是誕生在中國的。對于肝癌大國來說,如果真的能夠降低肝癌早診難度,可以說是功德無量了。
?另一項同樣來自中國科學家的研究給2型糖尿病帶來了新解決方案。國內的腸道微生物大牛趙立平教授團隊確定了膳食纖維飲食可以調節特定的腸道菌群,3個月的飲食干預可以使試驗中89%患者的糖化血紅蛋白達標。這項研究還鑒定到了特定的菌株,可以說是很厲害了。
其他的“腸道微生物教你吃”系列還包括紅肉害心血管、膳食纖維補骨等等,但天然食品表現出了各自的好,膳食補充劑卻有點跌跟頭。
?2018年,《細胞》雜志發了三篇論文,分別提出了補充益生菌和可溶性膳食纖維可能帶來的健康隱患。這二者均是我們常識中有助于健康的補劑,特殊情況下還可以用于緩解某些疾病的痛苦。但從這三項研究結果來看,腸道菌組成的個體化差異很大,流水線產品或許并不是相關問題的最佳解決方案。
?再多想一步,糞菌移植這項技術到底該走向何方還需要更多的考慮。
南方醫科大學進行的研究指出[1],跨全國14個省市的七千余人中,與腸道菌群最強的關聯因素是被試所處的地理位置,特定地區基于腸道菌的診斷模型,很可能不能推廣到其他地區。
國外學者的研究也顯示[2],腸道菌在很大程度上受到飲食、藥物等各種因素影響。那么在進行糞菌移植的時候,為了保證目標菌的穩定定殖,這些因素是否需要考慮進去呢?
?除此之外,在國內,糞菌移植到底在什么情況下使用、到底歸類為哪一種治療、相關的臨床和菌群資料如何管理等等更多相關倫理和政策的問題也需要解決。

不管怎么說,縱觀過去一年,不難看出研究方向正在走向更加精準,重磅結果往往都標配特定的菌種乃至菌株。正如趙立平教授所說,不同菌株間基因序列差異遠大于人與小鼠的區別,研究精確到菌株是精準治療的前提。
?其實以腸道的神秘地位、微生物漫游人體的自由度,腸道微生物涉事之廣,必然遠不止目前我們所了解的這些,這個領域絕對還有大把令人震驚的未知等待發掘,而走上臨床的腸道菌也僅僅是剛起步。
?總而言之,你的人生,腸道微生物永遠不會缺席。
?二甲雙胍到底還有多少我們不知道的功能?
?辭別舊日網紅,該迎新神上位了。
?說起神藥,大家第一個想到的必然是阿司匹林。俗話說長江后浪推前浪,前浪拍成沙茶醬,阿司匹林去年迎來一波神格下跌,新神可在路上一往無前呢。
?滿打滿算,2019年,二甲雙胍就正式在臨床服役62年了,它依舊是目前全世界處方量最大的口服降糖藥,地位無可撼動。直接把它一路送上神位的是,二甲雙胍不光能降血糖,什么護心、防癌、抗衰老,似乎都能手到擒來!
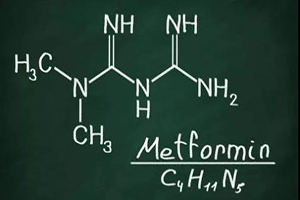
二甲雙胍的心血管益處已經寫進指南,就不多說了。二甲雙胍可能能抗癌這一點,很早之前就有流行病學證據顯示,使用二甲雙胍治療的2型糖尿病患者癌癥風險更低。
?復旦大學學者發表在《自然》雜志上的研究為我們揭示了其中的奧妙。原來,高血糖水平誘導特定表觀遺傳變化的通路,竟然和二甲雙胍降糖通路有重疊,下游更是涉及到了多個與癌癥相關的基因。
?另兩項研究則把這個結論推廣到了糖尿病患者之外的人群。科學家們發現,在腫瘤微環境中,天冬氨酸是腫瘤增殖的關鍵限速因素,缺少天冬氨酸,腫瘤就束手束腳。而2016年的一篇論文告訴我們,二甲雙胍可以降低細胞中天冬氨酸的水平。

還有更神的,二甲雙胍還能降解癌細胞的PD-L1!萬萬沒想到,免疫治療這個熱點集中營,二甲雙胍也能摻上一腳,“管閑事”能力堪比腸道微生物,哦,二甲雙胍和腸道微生物也有好幾腿……
?最令人獻上膝蓋的是,二甲雙胍竟然還有“防霾”功效,抑制霧霾引起的動脈血栓,預防心血管疾病發生。
?二甲雙胍為啥這么神?有科學家做了個研究,用新技術研究了一下二甲雙胍能夠影響到的分子通路,發現二甲雙胍至少能夠影響745種蛋白的活性。其實奇點君覺得,這個hdPCA技術勝在準確,在全面上還差了一些,這也說明二甲雙胍能夠調控的通路大概遠不止這幾百個。

縱觀這些“神藥”,大抵都經典、便宜、“萬能”。
阿司匹林和二甲雙胍的年紀都遠超在座的各位,它們誕生的那個年代,藥物研發還沒有今天這么精準,所以很多經典老藥都是知其然不知其所以然,用著用著就發現一條新作用通路,也沒啥奇怪的,至少阿司匹林和二甲雙胍這倆我們現在還沒全搞清楚呢。
?按照今天的這種先找靶點再對應開發的套路,恐怕以后很難再出現新的“神藥”了,且用且珍惜(笑)。
?不過“神藥”本來也難得,這么多年不就出了這么兩個。下一個是誰呢?奇點君決定捧一把他汀,看看它19年是否爭氣吧。如果真火了,記得回來打錢。?
?心血管還好嗎?
?同為慢性病,糖尿病和心血管疾病受到的關注度完全不一樣。這是奇點編輯部的一大未解之謎,就感覺我們讀者,好像也不咋在乎自己的小心臟。
?為什么這樣呢,明明按照某指南,在座一半人都高血壓了啊?

說起美國心臟協會(AHA)和美國心臟病學會(ACC)17年尾發布的這個新版高血壓臨床指南,奇點君自己也覺得膽戰心驚,高血壓門檻降到了130/80mmHg,讓很多人都大呼“怎么我一覺醒來就高血壓了?”北京阜外醫院做了個調查,根據這版指南的標準,中國成年高血壓患者已經超過5億了!
?不過中國人是心真大。。。雖然患者人數坐火箭似的竄,但患者知曉自己患病和接受治療的比例都不到一半,患者血壓控制達標率僅有15.3%。哦,要是按照AHA/ACC的標準,就只有3%……
朋友們,不要以為自己年輕就可以作天作地了,病到頭上饒過誰啊!

那就提前開始預防唄?可惜,預防心血管疾病的阿司匹林和深海魚油這兩大扛把子,都坑了。
?2018年中,《柳葉刀》和《新英格蘭醫學》雜志兩大頂級期刊分別發文,指出阿司匹林用于心血管疾病一級預防的一些問題,一是指南推薦的劑量并不適用于所有體重的患者,二是這個用法對中低危和糖尿病患者基本也沒有健康收益。
?一時間議論紛紛,曾經的神藥,說不好就此跌下神壇,也有些令人感慨廉頗老矣。
而ω-3脂肪酸補劑,AHA給出的冠心病二級預防建議,也分別在隊列研究和對照試驗中折戟。順便一說,ω-3脂肪酸的藥物版本的確可以用來治療高膽固醇,但是藥物和補充劑的使用還是有區別的。
?新的一年里,保護小心臟可以從改變生活方式做起,比如說多吃西蘭花,每天一個雞蛋,以及好好保護牙齒。對了,北大團隊的結果也說,那些血小板低的高血壓患者大可以嘗試下補葉酸,防中風效果還是挺好的。
?阿爾茨海默病快放晴了嗎?
?之前年刊寫到阿爾茨海默病的時候,兩個子標題都沒有離開“迷霧”這個關鍵詞。不知道病怎么來,不知道病怎么發展,更不知道怎么治,這個一問三不知還有著目前新藥圈最大的“3期臨床百分百失敗”設定,真的是夠讓人難受了。
?說實話,AD的新藥研發可能會越來越不樂觀。2018年1月,輝瑞宣布放棄所有神經退行性疾病研發管線,公司前研究和開發負責人John LaMattina指出,AD的研究非常昂貴,因為疾病進展緩慢,等待藥物起效可能需要數年時間,每個3期臨床試驗的費用可能在6-10億美元之間。
?LaMattina表示,就算是輝瑞這樣的頭部企業,也很難支撐起這么大規模的預算,其他大型制藥企業早晚也要跟著放棄,最終為了補這個研發的缺口,很可能是美國國立衛生研究院(NIH)來撒錢[3]。
?一語成讖。這話剛說了半年,美國國會即宣布,將NIH阿爾茨海默病和相關癡呆的年度預算直接乘3,總額達到19億美元;另外,NIH還發布了兩份2019年支出法案草案,在這方面的投入金額將達到23億美元,占NIH全年預算的5%[4]。
?這是NIH歷史上第三次把大量經費都集中在同一領域——第一次是1971年開始的癌癥戰爭,上一次則是為了對抗艾滋病。

很多研究者表示心情復雜,他們擔心經費集中會耽誤其他領域的發展,但卻沒什么人直言反對。AD確實快到刻不容緩的時候了,除了衛材和百進又把BAN2401的2期數據拿出來掙扎了一下之外,AD新藥的失敗名錄又多了一串名字,哎,不提也罷。
?其實β淀粉樣蛋白理論走到今天,臨床試驗屢屢敗走,已經容不得人不質疑了,反倒是一些“老”理論,在這風口浪尖上重獲生機,比如說皰疹病毒,終于暗搓搓地拿回了它AD幕后黑手的寶座。
?AD的病毒理論,其實能夠追溯到上個世紀五十年代,只是搞這個研究的學者是少數派中的少數派,無人問津不算慘,因為學術追求還要被嘲笑那是真的慘。幾十年的積累,病毒理論迎來一波大爆發,皰疹病毒之后,又有逆轉錄病毒摻一腳。關注奇點的讀者應該最近也有看到,2019年1月,又接連有幾篇相關論文發表,這里就不列舉了。
的來說,雖然藥物研發不甚樂觀,但我們對AD的認知進步是很大的,包括BACE1與神經功能的關聯、APOE突變致病的機制、tau蛋白的真實功能、β淀粉樣蛋白可能可以傳染,AD正在逐步揭開神秘面紗。
?另外還有一個繞不開的事件。中國海洋大學、中科院上海藥物研究所和綠谷藥業聯合研發的AD藥物甘露寡糖二酸(GV-971)宣布順利完成臨床3期試驗,能明顯改善患者的認知功能障礙。
研究論文目前還沒有發表,沒看到論文之前,奇點君也不好說些啥。
?既然是十問,那也不妨來個問中問,北大饒毅老師的實名質疑,質疑到結果了嗎?
CRISPR進入瓶頸了嗎?
?2018年,天之驕子CRISPR好像走進瓶頸期了。
?開年第一周,斯坦福大學學者論文質疑,CRISPR/Cas9系統真的能在人體內起效嗎?根據科學家們的實驗結果,七成健康人體內都存在Cas9蛋白同源物抗體,半數人具有特異性T細胞,這意味著目前最成熟的Cas9編輯在人體內的有效性和安全性都打上了問號。(注:這篇論文最終發了《自然醫學》)
?道理也很簡單,Cas9蛋白來源于微生物,尤其是金黃色葡萄球菌和化膿鏈球菌,這差不多是最常見的兩種致病菌了,幾乎100%的成人都具有相應的抗體。這意味著,人類的適應性免疫將會成為CRISPR/Cas9基因療法的巨大壁壘。

另外兩篇論文則將CRISPR與最常見的抑癌基因突變p53扯上了關系。來自卡羅林斯卡和劍橋的兩個團隊分別證實,CRISPR/Cas9基因編輯過程中造成的DNA雙鏈斷裂,實際上可以激活p53蛋白通路,編輯成功細胞往往具有p53缺陷——也就是潛在的癌細胞!從研究結果來看,涉及DNA雙鏈斷裂的基因編輯風險極大,很可能會增加臨床患癌風險。
?這還沒完,遺傳學大牛Allan Bradley團隊則證實,CRISPR/Cas9介導的雙鏈斷裂修復極有可能造成切割位點遠端DNA大片段丟失、乃至其他更為復雜的基因突變。從某種角度來說,這比脫靶還要嚴重,畢竟第一,丟失片段可能高達數千bp;第二,發生位置遠難以通過常規流程評估;第三,隨機性強,每個樣本編輯后基因型都有所不同,潛在致病模式多得無法想象。
?縱然Editas等前沿CRISPR企業面上淡定,但股價的過山車式波動實實在在地反映出了資本市場對技術的擔憂。

其實奇點君倒覺得,問題頻出,未必不是好事。
?CRISPR是由一位日本科學家命名的。1987年,他把這段搞不清楚作用的序列寫進了論文,可絕對沒有想到它們能以坐火箭的速度改變醫學世界。
?2012年前后,Jennifer Doudna、Emmanuelle Charpentier、張鋒和George Church四尊創世天神同時發力,證實了CRISPR作為一種基因編輯工具的無限潛力;之后不到一年,便有研究者開始嘗試利用CRISPR來矯正遺傳疾病;2016年,盧鈾進行了首個CRISPR編輯細胞回輸的臨床試驗;2017年,CRISPR實現單堿基編輯……
?快嗎?太快了,估計上一問搞AD藥物研發的同行都要流下淚來。

有句話不太好聽,步子邁太大,早晚要扯淡,還不如現在這樣一點點發現問題、一點點解決問題。現在科學家們也在開發CRISPR更加廣泛的潛力,比如說更多更優秀的Cas酶、更好的遞送方式、不切割雙鏈的編輯方法等等。
何況CRISPR作為一個編輯工具,確實是挺好用,快速、精準、體量小、自由度高,“基因魔剪”絕非浪得虛名。比如快速制造TCR-T、改造癌細胞大義滅親,CRISPR能做的還多著呢。
沒有技術是完美的,CRISPR更不是。科學需得一步一個腳印,每一步前進都是摸著石頭過河。2018年8月底,科學家終于首次實現了CRISPR/Cas9系統在大型動物體內的編輯,讓關注這個技術的人們狠狠興奮了一把。
當然,在另外一個“爆炸式進展”面前,如今看起來它也“不算什么”。
?他怎么樣了?她們怎么樣了?
?年度最不想吃的瓜,賀建奎。
?2018年11月25日,麻省理工的評論期刊MIT Technology Review發表了一篇報道[5],根據中國臨床試驗注冊中心發布的文件,把賀建奎事件拉上了水面。次日,該事件大規模發酵,賀建奎在YouTube上傳視頻,宣布一對名為露露和娜娜的雙胞胎女嬰于2018年11月8日出生,這是世界上第一例人類基因編輯嬰兒。
此處本來有一個賀建奎聲明視頻,但是傳了,沒過審
?該試驗招募的受試者為HIV攜帶者男性/健康女性夫妻,以CRISPR/Cas9技術對受精卵進行基因編輯,以得到具有CCR5基因突變人類胚胎。天然CCR5-Δ32突變攜帶者可在高風險暴露的條件下抵抗HIV感染。
?賀當時正在香港,準備參加11月27日舉辦的第二屆國際人類基因組編輯峰會。會議臨時為賀準備了發言時間。不知是因為賀英文水平所限,還是的確心里沒有底氣,整個問答環節只能說是避重就輕。
?在各界關注之下,事件有關細節逐一曝光,試驗目的、倫理審查、項目資金來源、臨床備案、安全性、知情同意等皆被質疑。
?峰會結束之后,賀建奎一度杳無音訊,傳言稱賀建奎被隔離在南方科技大學公寓中,公寓外有便衣執勤。這期間,賀與斯坦福大學William Hurlbut博士有郵件來往,稱自己“在雙方協議之下”居住在大學的公寓中,可以自由離開[6,7]。

?12月29日賀建奎在公寓陽臺
2019年1月21日,新華社公布該事件初步調查結果,最終定性為“賀建奎個人為追逐名利、自籌資金、蓄意逃避監管、私自組織有關人員,實施國家明令禁止的以生殖為目的的人類胚胎基因編輯活動”。

對于這件事,國內外學界幾乎是一邊倒的批評,僅有George Church發言較為中立,認為在HIV大流行的前提下,以預防艾滋病為目的的基因編輯并非無用功,但對開展胚胎編輯一事也持否定態度。 就試驗本身來說,受試者夫妻并不需要進行基因編輯就可以生下健康的寶寶,而且從結果來看,露露和娜娜的編輯也說不上成功;試驗之外,編輯人類胚胎是絕對違反國際倫理標準的行為,更遑論讓“實驗品”出生。
中國期待著世界領先水平,但絕不需要這樣的第一。
這件事疑點重重。賀建奎雖然并非遺傳學家,但總歸有生物物理學科背景,也算是相對有一定履歷的研究者,他會真的完全不了解個中風險嗎?所謂的“個人行為”是真是假?賀建奎這樣做的目的到底是什么?
期待進一步調查能夠解決以上的疑問。
《自然》雜志評選2018年度十大人物,賀建奎赫然在列。作為“反派”,賀建奎打開了基因編輯的“潘多拉魔盒”,給全世界投下一顆重磅炸彈。
奇點君的一個小觀點,不一定對。事物必然有惡性和良性兩面,賀建奎事件之后,相關立法和監管必然大幅前進,國際上對基因編輯倫理將有更加嚴謹、統一的認識,普通人也會對看似高深的科學領域有更深的了解。只要還在討論,就會進步。
有些人等待被審判、有些規則等待被建立、有些歷史等待被改寫。
唯一讓我們覺得無能為力的是,兩個女孩、或許還有更多尚在孕育的胎兒,只能被動地接受被他人編輯好的命運。

如涉及知識產權,請與我司聯系!
|