來源? 來源:藥時空
摘要
抗體藥物作為作為一種高劑量使用的生物制劑對產(chǎn)品純度以及雜質(zhì)殘留量要求非常嚴(yán)格另上游表達(dá)量越來越高產(chǎn)品要求也越來越高隨之而來的是下游純化壓力。如何快速獲得抗體的純化產(chǎn)品以及優(yōu)化其生產(chǎn)工藝成為藥物研發(fā)公司關(guān)注的要點(diǎn)。本篇文章介紹了抗體藥物發(fā)展史以及下游純化工藝的基本流程主要包括深層過濾低pH滅活中間品深層過濾離子層析除病毒過濾和超濾滲濾。
一 單克隆抗體簡介?
抗體是一類免疫球蛋白ImmunoglobulinIg當(dāng)母體受內(nèi)源或外源物質(zhì)刺激時B淋巴細(xì)胞特異性識別抗原決定簇從而促使一系列分化和分裂行為B細(xì)胞的終末分化細(xì)胞即漿細(xì)胞合成了抗體。每一個B淋巴細(xì)胞只能分泌一種識別、結(jié)合抗原決定簇的抗體。單克隆抗體(Monoclonal antibodiesMAbs)是由B淋巴細(xì)胞和骨髓瘤細(xì)胞雜交形成的雜交瘤細(xì)胞產(chǎn)生的具有高度均一性和特異性。
MAbs由兩條重鏈與兩條輕鏈構(gòu)成[1]其中重鏈分子量約為50~75KD含約450~550個氨基酸由一個可變區(qū)域V和三或四個恒定區(qū)域C組成具有介導(dǎo)重要的免疫學(xué)功能高等脊椎動物含有五種類型的重鏈γμαδε分別決定球蛋白的五種類型IgGIgMIgAIgDIgE[2]而輕鏈分子量為25KD含大約214個氨基酸由一個可變區(qū)域V和一個恒定區(qū)域C組成具有參與結(jié)合抗原并穩(wěn)定免疫球蛋白結(jié)構(gòu)的功能。一個二硫鍵將其中的一個重鏈和輕鏈連接起來這些二硫鍵處在一個被稱為鉸鏈區(qū)(hinge)的柔性部位上這個區(qū)域由12個氨基酸組成且易于被蛋白酶或化學(xué)物質(zhì)所切割。IgG可被木瓜蛋白酶水解為兩個相同以及一個不同片段兩個相同片段在溶液或凝膠中不能形成片段且以單價形式與抗原結(jié)合因此被稱為Fab?片段Fragment antigen binding抗原結(jié)合片段另一個不同片段不能與抗原結(jié)合且比Fab更容易產(chǎn)生結(jié)晶其結(jié)構(gòu)有更高的均一性被稱為Fc片段Fragment crystallisable可結(jié)晶片段[3]。抗體的重鏈以及輕鏈的可變區(qū)VH+VL稱為Fv片段Fragment variable不穩(wěn)定片段是一個能夠結(jié)合抗原的不穩(wěn)定片段。可變區(qū)可被細(xì)分為高度可變區(qū)或者CDRscomplementarity-determining regions互補(bǔ)決定區(qū)該區(qū)域直接和抗原或框架區(qū)域用作CDR與抗原接觸的支架結(jié)合[4]。如下圖1-1
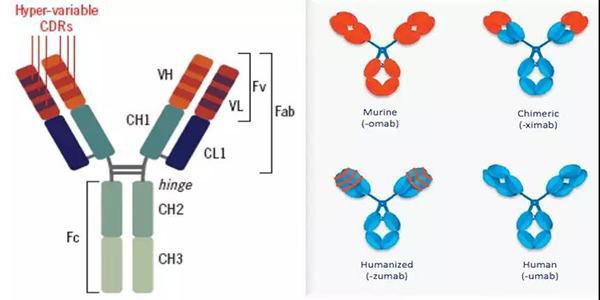
圖1-1 單克隆抗體示意圖? ? ? ? ? ? ? ? ? ? ? 圖1-2 單克隆抗體類型
Kohler和Milstein兩位科學(xué)家于1975年發(fā)明了單克隆抗體技術(shù)[5]也因此獲得了1984年的諾貝爾醫(yī)學(xué)獎。隨著基因工程技術(shù)的迅速發(fā)展治療性MAbs從早期100%的鼠源MAbs到人-鼠嵌合抗體、人源化抗體再到全人源性抗體如圖1-2并衍生出雙特異性抗體[6]納米抗體等多種新型抗體藥物逐漸解決了異源性抗體的免疫原性問題。以下是針對鼠源抗體到新型抗體藥物發(fā)展的相關(guān)介紹。
1.鼠源抗體(Murine antibody)使用異種抗原免疫小鼠然后通過純化小鼠腹水得到針對該抗原的多克隆抗體再經(jīng)過骨髓瘤細(xì)胞融合得到可持續(xù)表達(dá)的單克隆抗體。1986年FDA批準(zhǔn)的全球首個單抗Orthoclone-OKT用于抗移植排斥的治療[7]。但是鼠源抗體可誘導(dǎo)產(chǎn)生HAMAHuman Anti Mouse Antibody人抗鼠抗體使鼠源抗體加速清除增加病人后續(xù)應(yīng)用的臨床風(fēng)險。
2.人-鼠嵌合抗體Chimeric antibody恒定區(qū)來自人IgG可變區(qū)來自鼠MAbs是一個人-鼠雜合的抗體。該抗體不僅能大幅度降低異源抗體的免疫源性其人源Fc片段還能有效介導(dǎo)生物學(xué)效應(yīng)功能如CDCComplement dependent cytotoxicity補(bǔ)體依賴性細(xì)胞毒作用ADCCAntibody-dependent cell-mediate dcytotoxicity抗體依賴細(xì)胞介導(dǎo)的細(xì)胞毒作用[6]等。
3.人源化抗體(Humanized antibody)小鼠CDRs與人的抗體框架嫁接經(jīng)親和力重塑保留親本鼠單克隆抗體的特異性和親和力幾乎完全去除免疫原性和毒副作用。
4.全人抗體(Human antibody)通過轉(zhuǎn)基因技術(shù)?將人類編碼抗體的基因全部轉(zhuǎn)移至基因工程改造過的抗體基因缺失的動物中從而使動物表達(dá)人類抗體達(dá)到抗體全人源化的目的。
5.雙特異性抗體Bispecific antibody一種人造蛋白由于重鏈與輕鏈來源于不同的抗體所以可以與兩種特異的抗原結(jié)合。雙特異性抗體的優(yōu)勢表現(xiàn)在增強(qiáng)了腫瘤細(xì)胞的殺傷力可以同時阻斷兩個不同信號路徑通過兩個不同細(xì)胞表面抗原相互作用增加特異性結(jié)合[8]。?
二. 國內(nèi)外單克隆抗體研究進(jìn)展及發(fā)展趨勢?
MAbs藥物因其靶向性強(qiáng)、特異性高和毒副作用低等優(yōu)勢迅速在腫瘤和自身免疫病等領(lǐng)域得到廣泛應(yīng)用市場規(guī)模成長迅速。據(jù)EvaluatePharma統(tǒng)計(jì)全球在研抗體藥物占所有在研生物藥的70%。至此FDA共有38個治療用抗體藥物其中包括Fc和Fab融合蛋白被批準(zhǔn)上市其中有2個抗體由于臨床在批準(zhǔn)上市后退市。2011年Top50生物藥物中有14個為抗體藥物前6位全部是抗體藥物年銷售額均超過50億美元。其中第一位是abbott公司的Humira2011年銷售額達(dá)到79億美元。FDA批準(zhǔn)的MAbs類藥物中40%用于治療癌癥33%用于治療自身免疫10%用于器官移植治療5%用于治療感染12%應(yīng)用于其他疾病。雖然生物技術(shù)制藥市場還比較小例如在2011年生物技術(shù)制藥只占全球藥物生產(chǎn)市場的15%但是抗體藥物的復(fù)合增長率卻很高為40%。同時各大原研單抗的專利陸續(xù)到期EMAEuropean Medicines Agency歐洲藥品局和FDA生物仿制藥申報法規(guī)的陸續(xù)出臺為單抗類生物仿制藥的井噴式發(fā)展提供了絕佳窗口。
中國的MAbs產(chǎn)業(yè)起步較晚研發(fā)工藝能力與發(fā)達(dá)國家存在巨大差距至2016年本土研發(fā)生產(chǎn)并上市的單抗及Fc融合蛋白類產(chǎn)品僅10個。國內(nèi)MAbs藥物行業(yè)面臨的主要問題有
1.動物細(xì)胞大規(guī)模培養(yǎng)表達(dá)量遠(yuǎn)低于國外水平。國內(nèi)細(xì)胞大規(guī)模的表達(dá)量一般在
0.5-1g/L并且工業(yè)化生產(chǎn)規(guī)模小最大的為3000L。而國外上市的藥物的表達(dá)量在2g/L左右臨床的表達(dá)量在3-5g/L之間
2.MAbs純化工藝水平較低。FDA在2005年已經(jīng)要求使用QbDQuality by Design,質(zhì)量源于設(shè)計(jì)的研究方式研究生產(chǎn)工藝。現(xiàn)在國內(nèi)僅有少數(shù)研發(fā)企業(yè)使用QbD的模式而且多數(shù)企業(yè)使用傳統(tǒng)的研究方法。如何降低工藝成本提高收率提高工藝穩(wěn)定性在抗體藥物研發(fā)中是非常重要的。
差距意味著潛力和機(jī)遇國內(nèi)腫瘤發(fā)病率持續(xù)上升構(gòu)成的龐大市場需求極大刺激了本土企業(yè)開發(fā) “新藥創(chuàng)制重大專項(xiàng)”在公布的2016年計(jì)劃資助100多個項(xiàng)目中單抗項(xiàng)目數(shù)占16%。據(jù)不完全統(tǒng)計(jì)截止2016年11月國內(nèi)共有超過90家企業(yè)涉足單抗藥物研發(fā)相關(guān)研發(fā)項(xiàng)目超過280個。不久后的中國單抗市場注定會呈現(xiàn)爆發(fā)式增長局面預(yù)計(jì)2020年將有6-10個新的本土單抗被推向市場。
近年來是MAbs發(fā)展的黃金時期但是還需要面對另一個客觀事實(shí)目前國際上針對熱門靶點(diǎn)的單抗項(xiàng)目眾多比如針對TNF的項(xiàng)目超過40個VEGF/VEGFR單抗項(xiàng)目超過35個HER2超過25個。因此上市速度將會是決定產(chǎn)品市場地位的一個重要因素而以高產(chǎn)能效率、高靈活性、低生產(chǎn)成本為主要特點(diǎn)的一次性技術(shù)產(chǎn)品也必將在未來的生物工藝解決方案市場大放異彩。近幾年上市的MAbs體現(xiàn)了下一代MAbs藥物研發(fā)趨勢
1.減小MAbs分子量從而更有利于藥代動力學(xué)以及藥效學(xué)參數(shù)改善制劑的屬性更利于生產(chǎn)。例如單鏈MAbs以及MAbs的結(jié)構(gòu)域。
2.通過已知的藥物的分子模型創(chuàng)造新的藥物。兩個或兩個以上的生物功能分子形成融合蛋白MAbs片段形成多價或多特異性。例如雙特體MAbs。
3.提高新一代的MAbs的生產(chǎn)能力以及其在生產(chǎn)過程中的穩(wěn)定性和產(chǎn)品的穩(wěn)定性。
4.提高藥物的關(guān)鍵參數(shù)如MAbs的半衰期和體內(nèi)分布免疫的安全性。
5.提高藥理作用即目標(biāo)的特異性和結(jié)合特性包括親和力和結(jié)合動力學(xué)。?
三.單抗純化工藝與優(yōu)化?
1.三步純化策略?
在每一個生物技術(shù)工藝中生物反應(yīng)階段后要考慮進(jìn)行兩個子工藝即回收和純化這兩步操作也被稱為下游工藝。回收步驟包括培養(yǎng)基分離、細(xì)胞破碎、殘片去除等初步單元操作。殘留的產(chǎn)品實(shí)際上是包含目標(biāo)蛋白且具有不同物理化學(xué)性質(zhì)的蛋白復(fù)合物?[9]。可見從如此混雜的蛋白中提取一種目的蛋白是一件非常艱巨的工作。故蛋白純化工藝應(yīng)建立在良好的蛋白理化性質(zhì)基礎(chǔ)之上合理并充分利用處理技術(shù)方法和參數(shù)盡量優(yōu)化工藝步驟設(shè)計(jì)一系列高效低耗和易于實(shí)行的蛋白質(zhì)純化分離方案[10]。
在生物制藥產(chǎn)業(yè)三步純化策略用于幫助治療性蛋白純化工藝的開發(fā)并且在實(shí)驗(yàn)室開發(fā)純化方法時同樣有效。注意三步純化策略并不是指所有的純化策略都應(yīng)該包括這三部純化步驟。
1捕獲粗純
該步驟目的是分離、濃縮、穩(wěn)定目標(biāo)蛋白。產(chǎn)品被濃縮轉(zhuǎn)移到一個可以維持其效能、活性的環(huán)境。最好可以去除其他關(guān)鍵雜質(zhì)。
2.中間產(chǎn)品純化
該步目的是去除大部分性質(zhì)相似的雜質(zhì)例如其他蛋白質(zhì)和核酸、內(nèi)毒素和病毒。
3.精制
這一過程目的是去除一些微量的和分子量相近的雜質(zhì)和多聚體。?
2.單抗純化操作流程?
下游工藝先通過澄清發(fā)酵液捕獲MAbs再通過一系列層析單元操作組合純化MAbs。該過程中還包括專門用于病毒滅活和去除的兩個正交步驟。然后通過滲濾和超濾步驟將抗體制成適于藥物產(chǎn)品制造的混合物和濃度。制成的產(chǎn)品經(jīng)0.2μm除菌過濾器過濾裝入適當(dāng)?shù)娜萜髦胁⒗鋬霰4妗Abs下游純化過程包括8個步驟如圖2-1
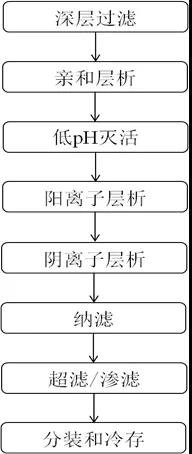
? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?? 圖2-1?蛋白純化流程?
1.深層過濾Depth FiltrationDF
也稱澄清過濾屬于流體通過多孔介質(zhì)的滲流[11]用于系統(tǒng)清除殘留的固體和較小的細(xì)胞碎片。深層過濾器通過兩種主要機(jī)制確保顆粒和溶質(zhì)的正常流動分離篩分和吸附。基本過程分為兩個階段第一階段是輸送階段懸浮顆粒在多種力的作用下向?yàn)V料表面遷移[12]第二階段是附著階段顆粒在各種物理化學(xué)力、流體剪切力、碰撞力等的作用下附著在濾料表面并被截留、捕獲。其高容量是由于污染物被捕獲并保留在介質(zhì)的整個深度中而不是僅被保留在過濾器的表面上[13]。高表面積和帶電相互作用的可能性意味著深層濾器除了具有捕獲較大顆粒的能力之外還具有吸附性能[14]。
2.親和層析Affinity ChromatographyAC
親和填料含有一種名為Protein A的配基。Protein A一種從金黃色葡萄球菌細(xì)胞壁中獲得的蛋白質(zhì)具有與免疫球蛋白選擇性相互作用的能力IgG通過氫鍵和兩個鹽橋的疏水相互作用使其Fc區(qū)與蛋白A結(jié)合[15]。
AC是單抗純化第一步可使蛋白純度達(dá)到95%以上[16]。該步驟目的是從澄清的收獲液中捕獲單克隆抗體同時去除工藝相關(guān)雜質(zhì)HCPHost Cell Protein宿主細(xì)胞蛋白DNA和小分子雜質(zhì)。
3.低pH滅活
也稱病毒滅活滅活可能存在于哺乳動物細(xì)胞培養(yǎng)物中的治療性蛋白質(zhì)產(chǎn)品中的脂包膜病毒。脂包膜病毒的主要功能是幫助病毒進(jìn)入宿主細(xì)胞。在pH3.9及以下可以有效滅活脂包膜病毒pH越低滅活病毒效果越好。
4.陽離子層析Cation Exchange ChromatographyCEX
離子交換色譜分離生物分子的基礎(chǔ)是待分離物質(zhì)在特定條件下與離子交換劑帶相反電荷因而能夠與之競爭結(jié)合[17]。該步驟的目的既將多聚物蛋白質(zhì)聚集體對治療性蛋白質(zhì)產(chǎn)物的免疫應(yīng)答構(gòu)成風(fēng)險[18]降低至藥物的可接受水平又將HCP降低到可接受的水平以便后續(xù)的陰離子層析處理。
5.陰離子層析Anion Exchange ChromatographyAEX
該步驟目的是去除HCP、DNA、Protein A和內(nèi)毒素達(dá)到藥物的水平物質(zhì)驗(yàn)收標(biāo)準(zhǔn)。同時也起到病毒清除的作用。
6.納濾NanofitrationNF
為了保證產(chǎn)品安全潛在的病毒污染物通過使用傳統(tǒng)上被認(rèn)為可靠的用于病毒清除的納米過濾器去除[19]。NF去除可能存在于哺乳動物細(xì)胞培養(yǎng)物產(chǎn)物中的細(xì)小病毒如小鼠微小病毒minute virus of miceMVM和較大病毒如小鼠白血病病毒murine leukemia virusMuLV。納米膜是一種功能性的半透膜[20]NF只與目的蛋白和病毒分子的大小有關(guān)依據(jù)蛋白分子量和膜截留量大小選擇合適孔徑的膜以壓力差為推動力從而達(dá)到顯著去除病毒的目的[21]。
7.超濾/滲濾UltrafiltrationUF/ DiafiltrationDF
UF基于膜孔徑或分子量截留分離溶液中的分子如圖2-2。DF常用于在恒定體積下改變回流溶液的化學(xué)性質(zhì)如圖2-3。?不需要的顆粒通過膜同時通過添加置換緩沖液將原料液的組成改變?yōu)楦硐氲臓顟B(tài)。在生物技術(shù)中滲濾通常用于將產(chǎn)物交換到最終制劑緩沖液中[22]。UF和DF常使用切向流過濾[23]其中料液平行流過膜表面而過濾的同時也對濾膜進(jìn)行了沖刷使膜表面不會形成凝膠層從而使料液中的顆粒不會很快堵塞濾膜。該步驟目的是確保單克隆抗體制劑和濃度達(dá)到藥物規(guī)格。
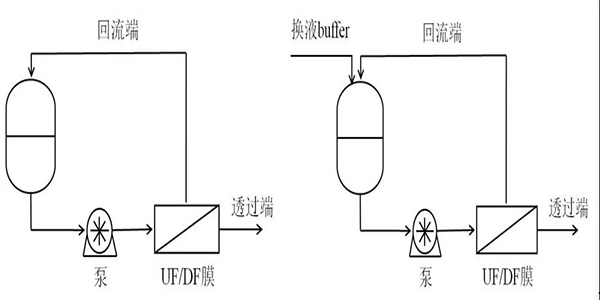
圖2- 2 超濾裝置? ? ? ? ? ? ? ? ? ? ? ? ?圖2- 3 滲濾裝置?
3.優(yōu)化方法?
1.實(shí)驗(yàn)設(shè)計(jì)Design of ExperimentDoE
DoE顧名思義就是設(shè)計(jì)實(shí)驗(yàn)的過程用于收集易于用統(tǒng)計(jì)方法分析的數(shù)據(jù)從而得出有效客觀的結(jié)論[24]。實(shí)驗(yàn)設(shè)計(jì)在科學(xué)和工程學(xué)領(lǐng)域是改進(jìn)產(chǎn)品實(shí)現(xiàn)過程非常重要的手段也是制造過程設(shè)計(jì)與開發(fā)和過程管理中的重要元素。我們可把實(shí)驗(yàn)看做科學(xué)研究的一部分或?qū)⑵湟曌鬟^程運(yùn)行方式和探究系統(tǒng)的一種途徑。一般來說先針對某一過程提供一些猜測接著進(jìn)行實(shí)驗(yàn)操作然后產(chǎn)生這一實(shí)驗(yàn)的相關(guān)數(shù)據(jù)再利用來自這一實(shí)驗(yàn)的信息設(shè)立另一個新的猜測這一新的猜測又導(dǎo)出另一個新的實(shí)驗(yàn)。
該技術(shù)允許我們通過少量的實(shí)驗(yàn)獲得足夠多的數(shù)據(jù)只需要在實(shí)驗(yàn)過程中系統(tǒng)的改變實(shí)驗(yàn)因素。基于所獲得數(shù)據(jù)可以建立一個用于研究工藝的數(shù)學(xué)模型以此獲得實(shí)驗(yàn)因素對結(jié)果的影響并找到最佳的工藝條件。可借助現(xiàn)代軟件創(chuàng)建DoE、獲取數(shù)學(xué)模型、使產(chǎn)生的信息可視化。DoE常用的方法是確定一個中心點(diǎn)然后圍繞改點(diǎn)進(jìn)行代表性的實(shí)驗(yàn)。DoE可以極大地提高篩選合適的實(shí)驗(yàn)條件的效率。
2.高通量篩選High Through ScreeningHTS
為了提供一個簡單的用來優(yōu)化純化MAbs的工具人們在建立DoE與96孔板實(shí)驗(yàn)結(jié)合的基礎(chǔ)上開發(fā)了HTS方法[25]。96過濾孔板可以根據(jù)實(shí)驗(yàn)者的實(shí)驗(yàn)設(shè)計(jì)需求自由填充不同微量的填料孔板中層析填料和目標(biāo)蛋白之間的基本相互作用和層析柱中是一樣的。HTS應(yīng)用于早期層析篩選實(shí)驗(yàn)既節(jié)省時間節(jié)約成本又加速工藝開發(fā)和優(yōu)化進(jìn)程[26]。工藝開發(fā)過程中的HTS技術(shù)可以允許大型實(shí)驗(yàn)空間的表征、支持已經(jīng)建立的良好的設(shè)計(jì)空間的確認(rèn)從而控制被監(jiān)測的關(guān)鍵工藝參數(shù)、減少臨床時間。?
總結(jié)
抗體在下游純化工藝中主要經(jīng)過捕獲富集中度純化去除大部分雜質(zhì)精細(xì)純化去除一些微量的和分子量相近的雜質(zhì)根據(jù)目的不同從而獲得較高純度的產(chǎn)品。
參考文獻(xiàn)
[1] 于傳飛, 王文波, 李萌, 等. 人源化抗VEGF單克隆抗體制品的大小異質(zhì)性分析[J]. 中華微生物學(xué)和免疫學(xué)雜志, 2014, 34(009): 718-722.
[2] Wilson K, Walker J. Principles and techniques of practical biochemistry[M]. Cambridge University Press, 2000.
[3] Spadiut O, Capone S, Krainer F, et al. Microbials for the production of monoclonal antibodies and antibody fragments[J]. Trends in biotechnology, 2014, 32(1): 54-60.
[4] Buss N A P S, Henderson S J, McFarlane M, et al. Monoclonal antibody therapeutics: history and future[J]. Current opinion in pharmacology, 2012, 12(5): 615-622.
[5] 潘萌, 孔蘊(yùn), 陳暢, 等. 單克隆抗體藥物的研究進(jìn)展[J]. 中國生化藥物雜志. 2008, 29(1): 62-64
[6] Ribatti D. From the discovery of monoclonal antibodies to their therapeutic application: An historical reappraisal[J]. Immunology letters, 2014, 161(1): 96-99.
[7] Liu J K H. The history of monoclonal antibody development–Progress, remaining challenges and future innovations[J]. Annals of medicine and surgery, 2014, 3(4): 113-116.
[8] Fan G, Wang Z, Hao M, et al. Bispecific antibodies and their applications[J]. Journal of hematology &>[9] Vásquez‐Alvarez E, Lienqueo M E, Pinto J M. Optimal synthesis of protein purification processes[J]. Biotechnology progress, 2001, 17(4): 685-696.
[10] 張建社, 禇武英, 陳韜. 蛋白質(zhì)分離與純化技術(shù)[M]. 軍事科學(xué)出版社, 2009.
[11] 康勇, 羅茜. 液體過濾與過濾介質(zhì)[M]. 化學(xué)工業(yè)出版社, 2008.
[12] 李孟, 劉新明. 國內(nèi)外深層過濾理論的最新研究進(jìn)展[J]. 中國水運(yùn), 2006, 6(10): 45-46.
[13] Merdy S L. Selection of Clarification Methods for Improved Downstream Performance and Economics[J]. Bioprocessing Journal, 2015. 14(1): 1538-8786.
[14] Yigzaw Y, Piper R, Tran M, et al. Exploitation of the adsorptive properties of depth filters for host cell protein removal during monoclonal antibody purification[J]. Biotechnology progress, 2006, 22(1): 288-296.
[15] Hahn R, Schlegel R, Jungbauer A. Comparison of protein A affinity sorbents[J]. Journal of Chromatography B, 2003, 790(1): 35-51.
[16] 陳泉, 卓燕玲, 許愛娜, 等. 蛋白A親和層析法純化單克隆抗體工藝的優(yōu)化[J]. 生物工程學(xué)報, 2016(1), 6: 010.
[17] 周楠迪, 田亞平. 《生物分離原理與技術(shù)》卓越課程建設(shè)的探索[J]. 教育教學(xué)論壇, 2014 (13): 198-199.
[18] Miesegaes G R, Lute S, Strauss D M, et al. Monoclonal antibody capture and viral clearance by cation exchange chromatography[J]. Biotechnology and bioengineering, 2012, 109(8): 2048-2058.
[19] Vázquez‐Rey M, Lang D A. Aggregates in monoclonal antibody manufacturing processes[J]. Biotechnology and bioengineering, 2011, 108(7): 1494-1508.
[20] 彭躍蓮. 膜技術(shù)前沿及工程應(yīng)用[M]. 中國紡織出版社, 2009.
[21] 張翠萍, 周安, 楊虎虎, 等. 人抗凝血酶Ⅲ納米膜過濾工藝優(yōu)化[J]. 中國輸血雜志, 2015, 28(12): 1481-1484.
[22] Houp R C. Ultrafiltration and diafiltration[J]. Journal of Validation Technology, 2009, 15(4): 40.
[23] Miao F, Velayudhan A, DiBella E, et al. Theoretical analysis of excipient concentrations during the final ultrafiltration/diafiltration step of therapeutic antibody[J]. Biotechnology progress, 2009, 25(4): 964-972.
[24] Douglash C.Montgomery. 實(shí)驗(yàn)設(shè)計(jì)與分析: 第6版[M]. 人民郵電出版社, 2009.
[25] Healthcare G E. High-throughput screening and optimization of a multimodal polishing step in a monoclonal antibody purification process[R]. Application note 28-9509-60 AB, 2009.
[26] 孫文改, 苗景赟. 抗體生產(chǎn)純化技術(shù)[J]. 中國生物工程雜志, 2008, 28(10): 141-152.
如涉及知識產(chǎn)權(quán)請與我司聯(lián)系??
|