來源:醫(yī)藥時(shí)間醫(yī)藥時(shí)間?
自2010年以來,針對(duì)腫瘤免疫療法的臨床捷報(bào)頻傳,引起科學(xué)界和資本界濃厚的興趣。
今天,我們就繼續(xù)來聊一聊腫瘤免疫療法研究方向之基于免疫檢查點(diǎn)抑制劑的免疫組合療法。
免疫檢查點(diǎn)抑制劑(anti-PD-1/L1或anti-PD-1/anti-CTLA-4)可以與化療、靶向療法、其他免疫檢查點(diǎn)抑制劑、免疫共刺激因子和CAR-T療法構(gòu)成組合療法,一方面是增強(qiáng)PD-(L)1的療效,另一方面也是目前克服PD-(L)1耐藥的主要策略。
簡而言之,基于免疫檢查點(diǎn)抑制劑的免疫組合療法就是:PD-(L)1+X。這里X將是一大批不同的東西,并且它將更加個(gè)性化,具體取決于腫瘤類型。
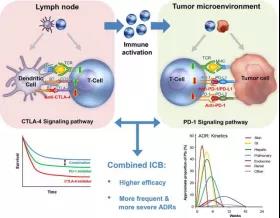
雙重阻斷療法:同時(shí)阻斷CTLA-4和PD-1
已知,CTLA-4與CD28競爭CD80/CD86配體,從而阻斷CD28共刺激信號(hào),而CD28信號(hào)是T細(xì)胞活化和效應(yīng)體功能強(qiáng)大所必需的。
同時(shí)阻斷PD-1和CTLA-4增加黑色素瘤中T細(xì)胞浸潤并減少Treg(調(diào)節(jié)性T細(xì)胞)和骨髓源抑制細(xì)胞數(shù)量,可進(jìn)一步提高黑色素瘤患者的總生存率,這在PD-L1高表達(dá)的患者中變現(xiàn)更明顯。
目前,抗CTLA4和PD-1的雙重阻斷療法已經(jīng)在治療晚期黑色素瘤、非小細(xì)胞肺癌和腎細(xì)胞癌方面已經(jīng)取得了成功,并且獲得了FDA批準(zhǔn)。
2015年,Ipilimumab(抗CTLA-4)和Nivolumab(抗PD-1)聯(lián)合治療晚期黑色素瘤獲得FDA批準(zhǔn)。
基于III期試驗(yàn)數(shù)據(jù)顯示,與單獨(dú)使用兩種藥物相比,Ipilimumab和Nivolumab聯(lián)合使用,一方通過阻滯上調(diào)對(duì)T細(xì)胞的啟動(dòng)控制,一方則改變腫瘤微環(huán)境,最后在晚期黑色素瘤患者中表現(xiàn)出前所未有的58%的反應(yīng)率和11.5%的完全緩解率,從而也增加了臨床采用組合療法的合理性。
當(dāng)然,與此同時(shí),該組合也帶來了更為頻繁的不良反應(yīng):24%的患者甲狀腺受到影響,垂體功能障礙(主要是垂體炎)者占9%,出現(xiàn)腎上腺功能不全(AI)者占4%,這一結(jié)果明顯高于Nivolumab單藥治療組。
Ipilimumab和nivolumab治療提高了反應(yīng)率和完全緩解率
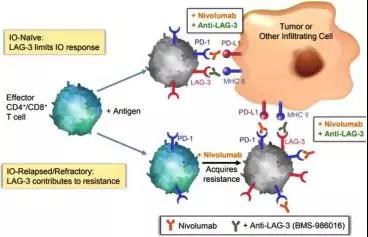
抗LAG3+抗PD-1協(xié)同增強(qiáng)抗腫瘤免疫作用
淋巴細(xì)胞活化基因3(LAG-3)被證明是一種免疫抑制受體,通常在活化的傳統(tǒng)T細(xì)胞、TREG細(xì)胞、B細(xì)胞和漿細(xì)胞樣樹突狀細(xì)胞上表達(dá)。LAG-3調(diào)控一個(gè)限制T細(xì)胞激活的檢查點(diǎn)通路
一直認(rèn)為的MHC-II是LAG-3的主要配體
LAG-3和PD-1受體在黑色素瘤的腫瘤浸潤淋巴細(xì)胞上過度表達(dá)和/或同時(shí)表達(dá)。目前已證明,同時(shí)阻斷LAG-3和PD-1可協(xié)同恢復(fù)T細(xì)胞活化,增強(qiáng)抗腫瘤免疫。
在百時(shí)美施貴寶公司開展的1/2a期研究中,聯(lián)合使用二者的抗體藥物([BMS- 986016]+[Nivolumab])顯示出良好的抗癌活性。
在后期更大范圍的聯(lián)合治療試驗(yàn)中:
-
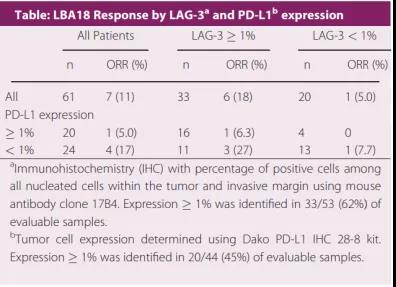
截止2017年6月15日,共治療68例患者,57%的患者曾接受過抗CTLA-4藥物治療,46%的患者曾接受過3種藥物治療;
-
在61例有效評(píng)估的患者中,ORR(客觀緩解率)為11.5%,DCR(疾病控制率)為49%;
-
無論P(yáng)D-L1表達(dá)與否,LAG-3表達(dá)超過1%的患者其響應(yīng)率比LAG-3表達(dá)小于1%的患者高出3.5倍。
綜合反映出二者聯(lián)合使用良好的抗腫瘤療效。
聯(lián)合治療試驗(yàn)結(jié)果一覽
溶瘤病毒注射促進(jìn)腫瘤內(nèi)T細(xì)胞浸潤,改善抗PD-1免疫治療
溶瘤病毒是一類能有效感染并消滅癌細(xì)胞的病毒。從機(jī)理上看,它不僅能直接殺傷腫瘤,而且還能刺激人體免疫反應(yīng),也可與免疫檢查點(diǎn)抑制劑聯(lián)合使用,增強(qiáng)免疫治療敏感性。
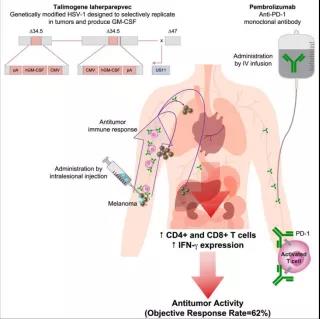
以Talimogene laherparepvec(T-VEC)溶瘤病毒為例。
T-VEC是一種經(jīng)基因改造過的1型單純皰疹病毒,可選擇性地在腫瘤中復(fù)制并產(chǎn)生粒細(xì)胞-巨噬細(xì)胞集落刺激因子(GM-CSF),從而增強(qiáng)抗原釋放、表達(dá)和全身抗腫瘤免疫反應(yīng)。
在之前的3期臨床試驗(yàn)中,與皮下注射GM-CSF相比,腫瘤內(nèi)注射T-VEC治療晚期黑色素瘤的持久反應(yīng)率有所提高。而其與CTLA-4抑制劑Ipilimumab聯(lián)合試驗(yàn)則顯示了比單獨(dú)使用Ipilimumab更好的抗腫瘤活性,且無額外毒性,這些結(jié)果是非常令人鼓舞的,特別是在溶瘤免疫治療領(lǐng)域。?在一項(xiàng)由加州大學(xué)洛杉磯分校參與開展的,針對(duì)21例晚期黑色素瘤患者聯(lián)合T-VEC與PD-1抗體藥物Pembrolizumab治療1b期臨床試驗(yàn)中發(fā)現(xiàn),
-
腫瘤的客觀緩解率高達(dá)62%,其中33%為完全緩解;
-
而對(duì)聯(lián)合治療有反應(yīng)的患者,在T-VEC治療后,其腫瘤中CD8+T細(xì)胞增多,PD-L1蛋白表達(dá)升高,多個(gè)腫瘤細(xì)胞亞群中IFN-γ基因表達(dá)增加;
-
聯(lián)合治療的反應(yīng)似乎與基線CD8+T細(xì)胞浸潤或基線IFN-γ信號(hào)無關(guān)。
這些結(jié)果提示,這一聯(lián)合療法的緩解率高于單獨(dú)使用Pembrolizumab或T-VEC治療的預(yù)期緩解率(通常約為35%-40%)。
溶瘤病毒結(jié)合抗pd -1治療增強(qiáng)了對(duì)癌癥的免疫識(shí)別,導(dǎo)致晚期黑色素瘤患者的高反應(yīng)率
免疫治療+抗血管治療
聯(lián)合其他治療方法,包括抗血管生成藥物,是目前正在研究的許多提高免疫治療反應(yīng)率和持續(xù)時(shí)間的策略之一。事實(shí)上,血管生成和免疫抑制被描述為可以同時(shí)發(fā)生的密切相關(guān)的過程。兩者都是參與非病理組織修復(fù)的生理機(jī)制,可用于腫瘤治療。
有趣的是,抗血管生成藥物會(huì)增加腫瘤缺氧并減少腫瘤內(nèi)血管的數(shù)量。另一方面,各種促血管生成分子已被證明存在于癌癥免疫循環(huán)的連續(xù)步驟中,如抗原遞呈→T細(xì)胞啟動(dòng)→T細(xì)胞轉(zhuǎn)運(yùn)→T細(xì)胞腫瘤浸潤,與一系列免疫抑制作用有關(guān)。
T細(xì)胞不能進(jìn)入腫瘤的一個(gè)原因可能是物理和生化障礙。腫瘤的一個(gè)標(biāo)志性特征是產(chǎn)生異常組織結(jié)構(gòu),腫瘤的血管網(wǎng)絡(luò)和很多細(xì)胞外基質(zhì)蛋白的表達(dá)都發(fā)生了顯著變化。腫瘤的血管網(wǎng)絡(luò)通過導(dǎo)致黏附分子的調(diào)控失常防止T細(xì)胞的遷移,這是T細(xì)胞浸潤的一大障礙。同時(shí),腫瘤增生造成的缺氧環(huán)境也有利于產(chǎn)生免疫抑制的腫瘤微環(huán)境。
值得注意的是,腫瘤包括熱腫瘤,即周圍有活化的腫瘤浸潤淋巴細(xì)胞(TILs),還有“冷”腫瘤,即邊緣缺少TILs或是被排斥的淋巴細(xì)胞。腫瘤中免疫細(xì)胞浸潤的存在或缺乏是影響多種免疫治療效果的重要方面。
目前正在研究的各種治療策略,目的就是重塑腫瘤微環(huán)境,使得腫瘤血管正常化,血管網(wǎng)絡(luò)正常化,以減少缺氧環(huán)境,提高1型輔助T淋巴細(xì)胞的浸潤和活性,使得免疫功能得到恢復(fù)。
而調(diào)控血管生成的分子可以通過至少三種方式影響免疫細(xì)胞及其與腫瘤的相互作用:
-
當(dāng)它們與免疫細(xì)胞表達(dá)的同源受體結(jié)合時(shí)產(chǎn)生直接影響;
-
誘導(dǎo)內(nèi)皮細(xì)胞蛋白表達(dá)改變的間接效應(yīng);
-
通過促進(jìn)血管正常化或減少新生血管而產(chǎn)生的間接物理效應(yīng)。
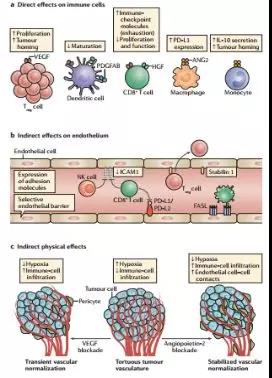
血管生成調(diào)節(jié)因子對(duì)免疫系統(tǒng)有三種既定的影響
2019年,拜耳、BMS和Ono三家公司簽訂臨床合作協(xié)議,評(píng)估拜耳的激酶抑制劑Stivarga(regorafenib)和BMS/Ono的抗PD-1單抗Opdivo(nivolumab)聯(lián)合使用的療效。該療法用于治療微衛(wèi)星穩(wěn)定性轉(zhuǎn)移性結(jié)直腸癌(MSS mCRC)患者。
這里提到的Stivarga能夠抑制促進(jìn)腫瘤生長的多種激酶,其中包括介導(dǎo)VEGF信號(hào)通路的激酶。
一項(xiàng)稱為REGONIVO的1b期臨床試驗(yàn)中,Stivarga和Opdivo聯(lián)用顯示出了良好的初步療效:
-
ORR為40%(98%CI 26~55),疾病控制率(DCR)為88%(95%CI 76~96);
-
GC患者治療反應(yīng)率為44%,所有對(duì)治療存在響應(yīng)GC患者均微衛(wèi)星穩(wěn)定(MSS);
-
MSS的CRC患者治療反應(yīng)率為33%,CRC患者人群的總體治療反應(yīng)率為36%;
-
對(duì)比治療前后,出現(xiàn)腫瘤客觀反應(yīng)的患者中可觀察到FoxP3hiCD45RA-Tregs的減少。
此外有研究證明,在結(jié)直腸癌CT26小鼠模型中使用抗PD-1抗體聯(lián)合抗VEGF抗體后,抗腫瘤效果得到改善,與對(duì)照組相比,腫瘤生長平均降低約75%。同樣,在注射了小鼠結(jié)腸癌C26細(xì)胞的腫瘤小鼠中,與單獨(dú)治療相比,聯(lián)合使用抗VEGFR2和抗PD -1單克隆抗體治療可增強(qiáng)對(duì)腫瘤生長的抑制作用。可見免疫治療聯(lián)合抗血管治療的優(yōu)良前景。
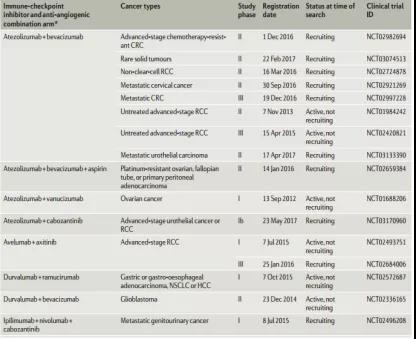
部分臨床組合試驗(yàn)進(jìn)程一覽
隨著免疫系統(tǒng)針對(duì)新靶點(diǎn)研究的不斷推進(jìn),以及相關(guān)臨床試驗(yàn)的廣泛開展,我們相信,腫瘤免疫組合療法也將迎來更多可能,從而在響應(yīng)率及不良事件改善率方面呈現(xiàn)更好的效果~
|