? ? ?? 來源:生物制品圈 ?
? ? ?? 摘要
? 基于PD1/PD-L1的治療給腫瘤治療帶來了革命性的改變,截止2018年底,超過100多種anti-PD1 和 anti-PDL1 處在研發的不同階段,超過2000多個臨床研究試驗注冊。抗體的特性需要通過生物學檢測方法判定其生物學活性。在本文中,我們開發了一種基于細胞的生物學檢測方式用來評估anti-PD1 和 anti-PDL1 抗體的生物學活性。我們選擇了包含兩個細胞系的受體報告系統,比較了超抗原,可溶性Anti-CD3抗體,膜型Anti-CD3抗體,嵌合抗原受體(CARs),雙特異性T細胞招募抗體對效應細胞的激活。我們對該生物測定方法進行了表征,并證明其可用于分析anti-PD1和anti-PDL1的活性。所提出的生物測定方法可用于開發新的治療藥物及其表征方法。
程序性死亡受體1(PD1)主要表達于激活的T細胞表面。PD-1+淋巴細胞?與攜帶PD-1天然配體(PD-L1 或 PD-L2)?的抑制性淋巴細胞結合后,將抑制PD-1+淋巴細胞的活性。PD1與其配體形成復合物導致了T細胞CD3依賴性激活被阻斷。盡管與PD1相互作用的精確序列仍然不清楚,但是與PD1相互作用的蛋白質,以及受這種相互作用影響的信號級聯已被確定。免疫反應的抑制,保護機體不受T淋巴細胞過度活化和自體免疫反應的影響,但同時也抑制了機體對腫瘤細胞的免疫反應。
?抑制PD1與PDL1的相互作用,而不是與PDL2相互作用,可以消除負性免疫調節,是治療某些類型腫瘤最成功的策略之一。2018年,T.Honjo由于在免疫負性調節研究中的突出貢獻,獲得了諾貝爾生理醫學獎。第一款PD-1和PD-L1抗體藥物分別在2014年和2016年上市。截止2018年年底,有關PD1/PD-L1抑制劑的臨床試驗高達2000多項。
?治療制劑的表征需要開發用于檢測其生物活性的合理方法。理想情況下,生物學分析方法應當反映生物制劑的作用機制,實現定量比較生物制劑的不同。目前所使用的方法要么受到專利的限制,要么是基于人體原代細胞,這使得它們使用不方便,結果再現性差。我們的目的實構建一種用于檢測anti-PD1 和antiPDL1抗體的生物學檢測方法,免于專利和原代細胞使用的種種限制。
? ? ?? 材料與方法
?材料
?DMEM/F12和RPMI1640培養基(PanEco, Russia)?,滅活的胎牛血清(Gibco,
USA)?,經典單克隆抗體抗人PD1 (aPD1)?,抗人PDL1 (aPDL1)?抗人CTLA4抗體,(aCTLA4) ,抗人HER2(aHER2)?,抗人CD3和腫瘤相關抗原1的雙特異性抗體(aCD3/aTAA1)?,以及抗人CD3和腫瘤相關抗原2的雙特異性抗體(aCD3/aTAA2) (BIOCAD,Russia)?鼠抗人CD3單克隆抗體,克隆號HIT3a(BD, USA)?;ONEGlo luciferase Assay System (Promega, USA)?和葡萄球菌腸毒素B(SEB)(Toxin Technology, USA)?.
?細胞系?
Jurkat和Raji培養于含10%FBS的RPMI1640;CHO-K1培養于含有10%FBS的DMEM/F12 。培養條件,37℃,5%CO2。所有細胞系用于基因工程化細胞株構建,所有細胞系均經過試劑盒以及PCR法檢測支原體污染。VenorTM GeM Mycoplasma Detection Kit, PCRbased (Sigma Aldrich, USA).
?載體構建
?基于pOGI載體(BIOCAD)?構建pOGI-NFATFLuc 質粒;該載體包含螢火蟲熒光素酶,受IL2啟動子控制,該啟動子中含有3個重復的NF-AT(激活的T細胞核因子)結合序列,該載體中還含有潮霉素抗性基因。
?基于pSX?載體(BIOCAD),構建了pSX-tmaCD3, pSX-PD1,和 pSX-PDL1?質粒。pSX-tmaCD3質粒包含抗人CD3抗體OKT3?單鏈可變區片段scFv,融合了血小板生長因子受體跨膜區,融合基因受CMV啟動子驅動,該載體也包含了嘌呤霉素抗性基因。pSX-PD1在多克隆位點插入了人PD-1基因,受CMV啟動子控制。該載體包含新霉素抗性基因。pSX-PDL1?包含了人PD-L1基因,受CMV啟動子控制,該載體還包含新霉素抗性基因。
?穩轉細胞系構建
?Jurkat NFAT FLuc?細胞系通過將pOGI-NFATFLuc?載體電轉化Jurkat細胞制備,在含有潮霉素B的培養基中培養篩選穩定細胞株。并通過加入aCD3?,篩選在aCD3?存在時,報告基因最高表達的穩轉細胞株。
?Jurkat NFAT FLuc PD1?細胞系通過將pSX-PD1 質粒電轉化進Jurkat NFAT FLuc?細胞制備,在含有新霉素的培養基中進行篩選,并通過流式細胞篩選表面高表達PD-1的細胞株。
?Raji PD-L1 細胞系通過將pSX-PDL1?質粒電轉化進Raji細胞,在含有新霉素的培養基中篩選,并通過流式細胞篩選高表達PD-L1的細胞系。
?Jurkat NFAT-FLuc PD1 CAR?細胞系來源于慢病毒轉導Jurkat NFATFLuc PD1細胞系,該慢病毒編碼一個嵌合抗原受體(CAR),該CAR通過T2A多肽鏈接子連接GFP熒光蛋白融合表達(BIO-CAD)。轉導細胞系通過流式細胞術篩選GFP陽性細胞,最終得到Jurkat NFAT-FLuc PD1 CAR細胞系。
?CHO PDL1 tmaCD3細胞系通過質粒pSX-PDL1 和pSX-tmaCD3轉染CHO-K1細胞,在含有新霉素/嘌呤霉素的培養基中得到篩選,最后通過流式篩選細胞表面高表達PD-L1和表達跨膜型CD3抗體aCD3 (tmaCD3)的細胞系,PD-L1通過PD-L1抗體檢測,aCD3通過FC檢測。
?生物學功能檢測
?在白色96孔板上進行發光分析(SPL Life Sciences, Korea Republic). 除非另有說明,細胞懸液中含有50,000 Jurkat NFAT FLuc每孔培養25,000個Raji PDL1細胞和1 ng/ml濃度的aCD3/aTAA1。在一些實驗中,Jurkat NFAT FLuc PD1細胞被替換為Jurkat NFATFLuc PD1 CAR細胞(每孔50000個細胞)或Raji PDL1細胞被Raji或CHO PDL1 tmaCD3細胞(25,000個/孔)。最終,每孔細胞懸液的體積為100ul。所有的反應都在含有10%FBS的RPMI1640培養基中進行,加上所有的反應原件,培養板在37℃,5%CO2 培養箱中培養16h,然后通過ONEGlo分析系統和SPARK 20M酶標儀(Tecan, Switzerland)讀取發光強度。
?數據處理
?根據方程,利用四參數logistic近似配位函數繪制細胞活化對抗體濃度的依賴關系曲線::
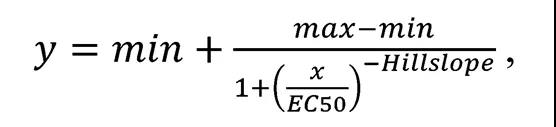
?其中x為抗體濃度,ng/ml;max是上漸近線;?min是下漸進曲線,坡面是曲線的曲率,EC50為半有效濃度,ng/ml。
這些圖是用SigmaPlot程序包(SYSTAT軟件)近似擬合得到的。所有的實驗測量至少進行了兩次。圖中所示值為所有重復的平均值;誤差條是標準差。
? ? ?? aPD1和aPDL1的穩定性
取濃度為25 mg/ml 的aPD1和aPDL1?50 μl,分別置于PCR管中,置于PCR反應器中(BioRad, USA)在指定的溫度下加熱處理1h,隨后的分析根據生物學功能分析操作指南進行。
? ? ?? 生物分析線性范圍
為了比較實驗值與期望值之間的差異,分別根據標準品反應最大值,?100μg/ml濃度為100%活性為參照,稀釋aPD1 和 aPDL1抗體濃度分別為最大活性的200, 140, 70, 和50%。再根據生物學功能分析操作指南進行。活度計算為標準樣品的實驗測定的EC50與給定濃度的實驗測定的EC50之比×100%。
? ? ?? 結果與分析
? ? ?? 細胞系的產生
在生物學分析中,最好使用永生化的細胞系來避免元代細胞準確性和重現性的問題。也可以通過基因工程手段得到想要的細胞表型。一個用于分析aPD1或 aPDL1抗體生物學活性的系統中,應該包括PD-1+的效應細胞和表達PD-L1的細胞。pd1介導的對CD3依賴激活的抑制意味著效應細胞必須在其表面攜帶有功能的CD3復合物。為了評估CD3依賴的激活,報告系統可以使用,例如熒光素酶報告系統。PD-L1和PD-1相互作用的結果是抑制了依賴于CD3激活的T細胞的NFAT和NF-κB(核因子,激活B細胞的κ輕鏈增強子)信號。最好使用NFAT介導的通路,因為NF-κB信號可以被很多其它物質刺激,例如CD3依賴激活的特異性標志物較少。
來自人T細胞的Jurkat細胞系符合用于CD3依賴的激活T細胞研究的要求,已經使用多達30年。在我們中,我們準備了NFAT FLuc PD1穩定細胞系,可以表達PD-1并且在NFAT反應的啟動子下,控制著報告基因的表達。
獲得了兩個PDL1+細胞系Raji和CHO PDL1 tmaCD3
? ? ?? 選擇一種細胞激活效應的方法
除了效應細胞外,測試系統還必須包括PDL1和CD3激活因子。利用PDL1+細胞作為PDL1的載體是目前最常用的物理方法。
? ? ?? 我們的測試系統已經考慮了CD3激活的幾個變體(圖1):
? ?? a)T cell受體(TCR)與特定肽形成復合物和主要組織相容性復合物(MHC)的相互作用最類似于其自身的作用機制(圖1a);
?? b)超級抗原可以結合在2型MHC(MHCⅡ)中TCRβ鏈,這一結構模擬了TCR與MHC/Peptide形成復合物(圖1b)。我們中用SEB作為超級抗原;
? ? ? c)可溶性的激活性anti-CD3ε抗體最為常用,以激活CD3(圖1.c);
? ? ? d)跨膜型的anti-CD3ε抗體也經常用于aPD1和 aPDL1抗體的生物學分析(圖1d);
? ? e)CAR+效應細胞是檢測aPD1和aPDL1的一個有趣的選擇。CAR的胞內結構域通常包含CD3ζ信號結構域,負責激活信號級聯反應,類似于完整的CD3復合物(圖1e)。據報道CAR-T治療結合PD1/PDL1抑制子更加有效;
? ? ?? f)T細胞招募型雙特異性抗體也可以用于CD3激活(圖1f)
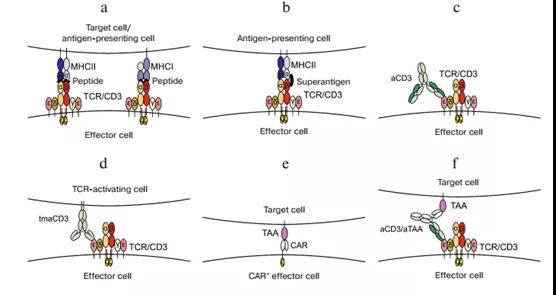
圖1.CD3激活方法在PD-1/PD-L1相互作用抑制劑生物學分析方法中的應用
由于通過TCR與MHC/peptide復合物的相互作用來激活需要更復雜的技術手段,我們不再深入探討.
起初選擇優化的CD3激活變體用于生物學分析開發,我們比較了可溶性的激活劑,例如αCD3抗體,aCD3/aTAA1,aCD3/aTAA2, 和SEB超抗原(圖2),通過兩個參數進行評價:絕對激活(包含效應細胞、靶細胞、激活劑和aPD1的系統中的發光強度)和相對激活(系統中的發光強度之比,即在上述系統中含有和不含有aPD1二者發光強度之比)。在含有aCD3/aTAA1和aCD3/aTAA2 激活劑的系統中,發光強度是含有aCD3 和SEB?激活劑系統發光強度的2-3倍。需要注意的是aCD3 和SEB?在本實驗中的使用濃度是用于T細胞招募濃度的1000倍和100倍。與上述CD3激活因子不同,可溶性aCD3激活了所有效應細胞,而不僅僅是那些直接與靶細胞相互作用的細胞。當使用PDL1+靶細胞時,PD1介導的CD3依賴性激活的抑制作用僅在某些效應細胞中存在。這造成了背景信號和較低的相對激活。在有aCD3/aTAA1 和aCD3/aTAA2?系統中,相對激活為5-6倍,aCD3 相對激活為1.5倍,SEB系統中相對激活為2倍。因此aCD3 和SEB激活劑相對于T細胞招募劑有較低的絕對激活和相對激活,在后續的研究討論中排除。而且SEB屬于有毒物質,在生物分析中不太受歡迎,如果有其它替代品時要慎用SEB.
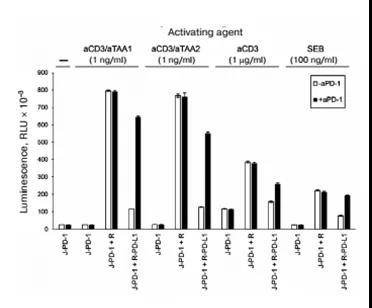
圖2.可溶性激活劑激活CD3依賴的NFAT信號
有趣的是,在只有效應細胞和可溶性aCD3組成的系統中加入Raji細胞可以提高效應細胞中熒光素酶的表達,這可能是由于aCD3與Raji細胞上Fc受體相互作用的結果.
可溶性CD3活化劑相對于跨膜活化劑分子的一個優點是可以對其濃度進行優化,使體系更加靈活(圖3)。在aCD3/aTAA濃度為0.1-1 ng/ ml的范圍內,aPD1對熒光強度的影響最大。在我們的實驗中,我們使用了1ng /ml的aCD3/aTAA濃度,這提供了最大的相對激活和最大的亮度絕對值。
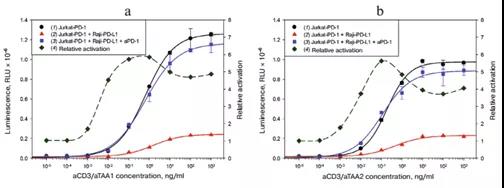
圖3.依賴于aCD3/aTAA的兩種變體的激活系統
此外,我們比較了四種生物測定法,每一種都基于一種激活方法:aCD3/aTAA的兩種變體、跨膜aCD3的靶細胞和CAR+ 的效應細胞(圖4)。在含有CAR+效應細胞的系統中,絕對激活高出其它激活形式的5倍。兩種aCD3/aTAA變體的相對激活是跨膜激活劑的2-3倍。同時,aCD3/aTAA1比aCD3/aTAA2的相對激活度高。基于這些數據,我們選擇aCD3/aTAA1激活CD3。
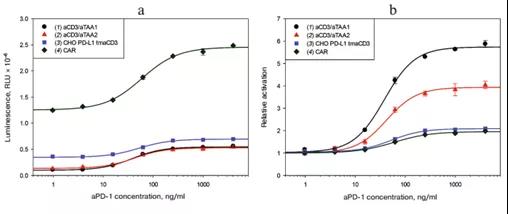
圖4.不同濃度aPD-1,不同激活劑激活報告系統
生物測定表征
為了證明所開發的生物測定法的特異性,我們用aPD1、aPDL1、aCTLA4和aHER2進行了檢測(圖5)。在本生物實驗中CD3依賴激活的抑制是通過效應細胞和靶細胞上分別存在的PD1和PDL1來保證的。NF-AT調控的熒光素酶的表達,是在加入aPD1 或aPD-L1 重激活效應細胞而實現的,aCTLA4 或 aHER2?不能實現效應細胞的重激活。樣品的發光強度與抗體濃度的關系可以用四參數邏輯斯蒂方程來描述,這使得比較被測樣品的EC50值成為可能。
? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 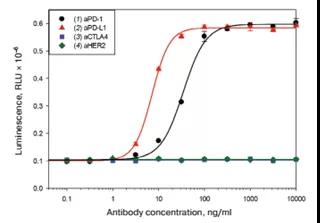
? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 圖5.報告系統特異性驗證
為了確定所開發的生物測定法鑒別不同活性的PD1/PDL1抑制劑的能力,我們使用了aPD1和aPDL1兩種承受熱應力的制劑(圖6)。我們觀察到EC50值與處理溫度之間的直接依賴關系。因此,本發明的生物測定法可以鑒別活性不同的aPD-1和aPDL-1制劑,并可用于其穩定性的測定。
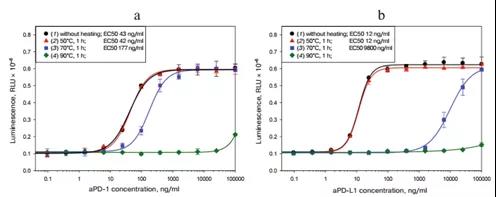
圖6.不同活性抗體對報告系統特異性驗證
只有在生物測定線性范圍內,才能確定被測制劑的正確活性。為了確認該生物測定的范圍在50%-200%內,以標準值100%激活為基準,設置aPD-1 和 aPD-L1?在預測標準值50,70.100,140,200% 5個濃度值激活該系統,測定發光強度(圖7)。實驗結果表明,這些制劑的活性接近預期值。該系統在aPD-1和aPDL-1標準的50-200%的活性范圍內是線性的。
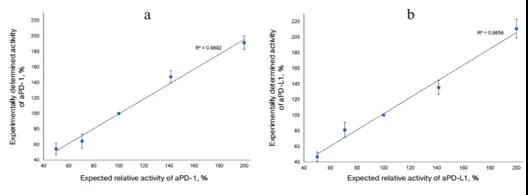
圖7.報告系統的線性范圍
我們開發了一種生物測定法來評價aPD-1和aPDL-1的生物活性。生物測定包括三種成分(圖8):(i)在表面呈現PD1的效應報告細胞系,其基因組中含有NF-AT反應元件啟動子控制下的螢火蟲熒光素酶報告基因;(ii)表面存在PD-L1的細胞系;(iii)雙特異性aCD3/aTAA抗體,用于激活報告細胞系中CD3依賴性NF-AT 信號,并將報告細胞與配體提呈細胞結合。
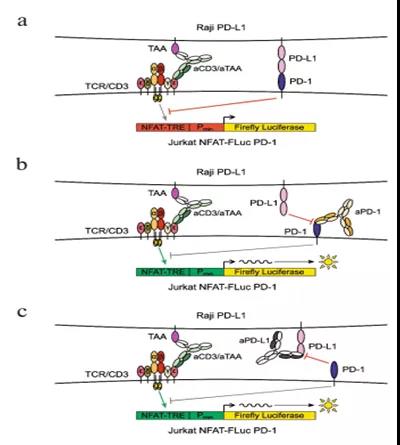
圖8.基于雙特異性T細胞招募抗體的生物學分析報告系統
我們比較了不同的CD3激活途徑,并在實驗中發現,當使用T細胞招募抗體作為CD3激活劑時,aPD-1添加后的相對激活最大(圖2和圖4)。T細胞招募抗體的其他優點是:低背景信號(相對于aCD3),沒有額外的基因工程操作(相對于CAR和tmaCD3),并且沒有毒性(相對于超抗原)。
值得注意的是,T細胞中CD3激活的兩個被考慮的變體——雙特異性aCD3/aTAA和CAR ,這是以前在測試PD1/PDL1抑制劑時沒有描述過的原始方法。早前報道了基于跨膜aCD3的aPD1或aPDL1活性評價系統。然而,這種方法是有專利保護的,使用范圍有限。我們開發了可以在aPD-1和aPDL-1開發階段使用的生物測定法,用于候選分子的比較和穩定性評估,以及對許多治療性制劑的表征,以確認它們的等價性,即,通常情況下,80-125%的標準抗體活性,線性范圍符合預期。
開發的生物測定方法可以進一步改進,例如,通過使用不穩定的熒光素酶來降低背景信號。
所提供的關于不同的激活劑激活CD3的數據可以用于開發新的治療試劑和檢測方法。
我們已經成功地將所開發的分析方法用于aPD-1和aPDL-1候選治療藥物的選擇和表征,目前正在進行臨床試驗。
? ? ?? 如涉及知識產權請與我司聯系??
|