? ? ?? 來源:弗雷賽斯
? ? ?? 今天和大家講下老牌雜志Elife IF:7.551上的一篇有關免疫治療預測標志物的文章。

? ? ? ? 1.研究背景
? ? ? 如今以免疫檢查點抑制劑(ICI)為代表的免疫治療正在改變癌癥的治療。然而,只有一小部分患者對ICI有反應,并且如今對可以識別出哪些患者更有可能對免疫治療有反應的生物標志物仍有廣泛的需求。ICI反應的基礎是腫瘤的免疫原性,免疫原性主要由腫瘤的抗原性和抗原呈遞效率決定。在此,作者提出一種測量腫瘤免疫原性評分(TIGS)的方法,該方法結合了腫瘤突變負荷(TMB)和抗原處理呈遞機制(APM)的表達特征。無論是與泛癌ICI反應率(ORR)的相關性,還是對個體患者的ICI臨床反應預測,TIGS始終比TMB和其他已知的ICI反應預測生物標志物表現出更好的性能。本研究表明TIGS是一種有效的腫瘤內在生物標志物,可用于ICI應答預測。
? ? ?? 2.材料和方法
? ? ? 1)?? 泛癌的臨床、基因表達以及免疫數據:下載33個TCGA組的泛癌水平RNA-Seq數據和臨床信息;從GEO數據庫下載細胞癌、皮膚鱗癌和小細胞肺癌的微陣列基因表達數據集。
? ? ?? 2)?? GSVA:采用GSVA法定量分析APM基因在免疫細胞類型中的表達狀態和浸潤水平。
? ? ? 3)? 評估免疫浸潤得分:樣本免疫滲透得分(IIS)被定義為巨噬細胞,DC子集,B細胞,細胞毒性細胞、嗜酸性粒細胞、肥大細胞,中性粒細胞,NK細胞子集,和所有的T細胞亞群的標準化值。
? ? ?? 4) 用于TIGS計算的APM評分標準化:公式如下APSnormalized= APS?APSpancan_minAPSpancan_max? APSpancan_min
? ? ?? 5)?? 用于TIGS計算的TMB數據的標準化:TMB被定義為每百萬堿基(Mb)基因組的非同義改變數。
? ? ?? 6)?? TIGS估算:使用公式TIGS= APSnormalized × log(TMB),這里用的是自然數。值得注意的是,一些腫瘤的TMB水平低于1個突變/Mb,因此在量化“腫瘤抗原性”時為避免出現負數,公式如下TIGS= APSnormalized × ln(TMB +1)。
? ? ?? 3.研究結果展示
? ? ?? ①APM 評分定義以及泛癌分析
? ? ? 抗原處理和呈遞的效率是決定腫瘤免疫原性的一個因素。在這里,作者使用APM過程中涉及基因的mRNA表達狀態作為這些抗原處理和呈遞步驟效率的指標。采用GSVA方法檢測APM基因的整體表達富集情況。在查閱文獻的基礎上,以下基因被選擇:PSMB5, PSMB6, PSMB7, PSMB8, PSMB9,PSMB10, TAP1, TAP2, ERAP1, ERAP2, CANX, CALR, PDIA3, TAPBP, B2M,HLA-A,,HLA-BHLA-C(圖1)。GSVA計算每個樣本一個特定基因的過表達水平,得到的GSVA評分被定義為APS。為了探索APS的泛癌分布模式,作者分析了TCGA中32種癌癥類型的約10,000個腫瘤(圖1)。圖1A的箱線圖顯示了TCGA癌癥類型中APS的巨大差異,這揭示了不同癌癥類型之間在抗原處理和呈遞效率方面的顯著差異。單變量Cox回歸分析表明,APS與癌癥患者的生存相關,有些具有統計學意義(圖1B)。且具有泛癌風險比值的Meta分析表明APS與預后無關(圖1B)。
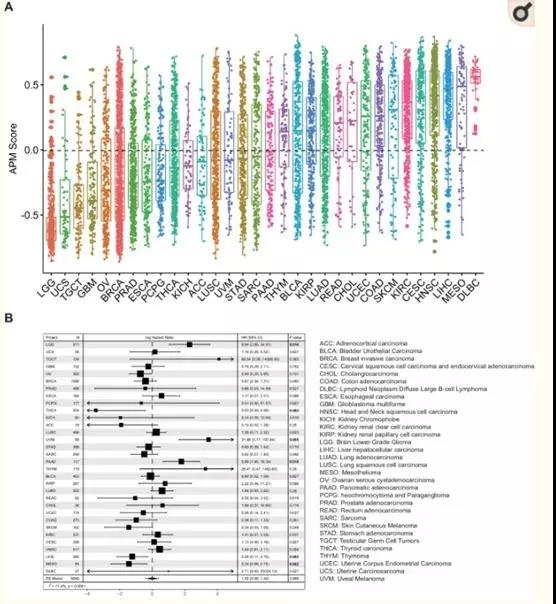
圖1
? ? ?? ②APS在癌癥中的確定和相關性
? ?? 為了識別決定患者APS狀態的特定基因特征,作者首先根據APS狀態對每種TCGA癌癥類型進行差異基因表達分析。中位數以上為APS高,中位數以下為APS低。差異表達基因(p-value < 0.01, FDR < 0.05)由logFC從高到低排序,然后選擇MSigDB的基因集進行基因集富集分析(GSEA)。在hallmark基因組的結果中,發現幾個基因特征(特別是干擾素/伽瑪反應)在大部分APS水平高的TCGA癌癥類型中富集,表明APS水平高與干擾素/伽瑪信號通路密切相關(圖2A)。GSEA進一步驗證了這一結果(圖2)。并且,干擾素伽瑪被報道調節APM基因表達,這與這一觀察是一致的。此外,免疫細胞浸潤評分(Immune score, IIS)通過GSVA計算,使用免疫細胞類型的標記基因列表,并通過CIBERSORT方法驗證。TIMER是另一種可以根據復雜組織的基因表達譜,準確分辨不同細胞類型相對分數的方法。為了進一步驗證計算出的IIS,作者進行了TIMER分析,發現TIMER結果與計算出的IIS高度相關(圖2)。也觀察到APS和IIS在癌癥類型水平和患者個體水平上的顯著相關性(圖2 B和C)。TMB與IIS的相關性較弱(圖2D和E)。
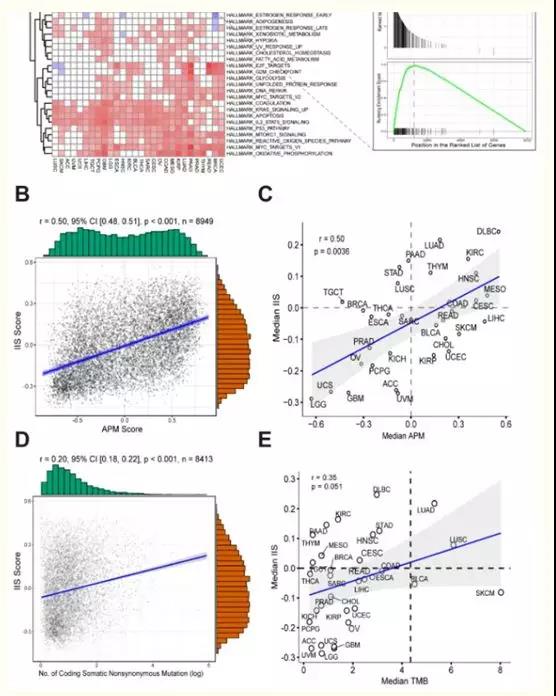
圖2
? ? ?? ③腫瘤免疫原性評分定義和泛癌分析
? ?? 腫瘤免疫原性由兩個因素決定:腫瘤細胞的抗原性和腫瘤抗原的加工和表達。這兩個因素是獨立的,都是腫瘤免疫原性測定所必需的。從理論上講,腫瘤免疫原性評分(TIGS)可以表示為[腫瘤抗原性]x[抗原處理及呈遞狀態]。首先作者計算了TMB和RNA-seq基因表達數據均可獲得的TCGA樣本的TIGS(32種癌癥類型,8413個樣本)(圖3A)。高TIGS的癌癥類型包括:皮膚黑色素瘤(SKCM)、彌漫性大b細胞淋巴瘤(DLBC)、結腸腺癌(COAD)、頭頸部鱗癌(HNSC)(圖3A)。單變量Cox回歸分析表明,TIGS與癌癥患者的生存相關,這種相關性在某些癌癥類型中具有統計學意義(圖3B)。涉及所有TCGA癌癥類型的Meta分析表明,在未接受免疫治療的患者中,高TIGS往往與不良預后相關(圖3B),這可能是由于其機制與導致高TMB的機制相同。
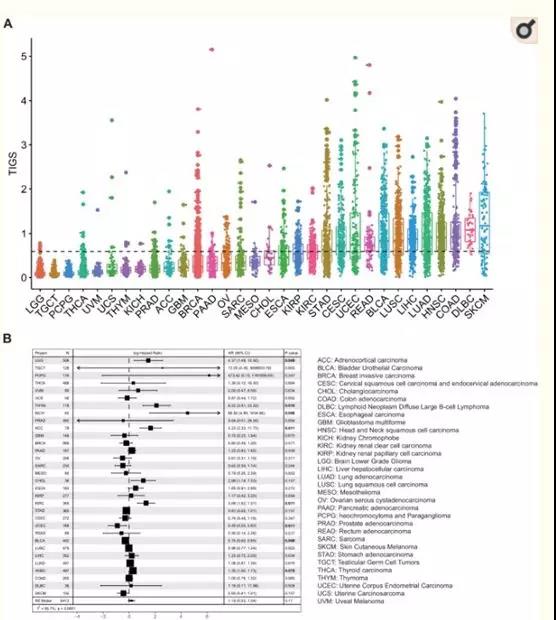
圖3
? ? ?? ④TIGS與泛癌ORR對PD-1的抑制作用
?? 計算TIGS,可以使用兩種不同的方法。在第一種方法中,APS和TMB信息來自于不同的研究。這種方法可以包含大量不同的癌癥數據集。在第二種方法中,所有的APS和TMB信息都是從相同的TCGA數據集中獲得的,在這種情況下,可用于研究的癌癥類型少。在TCGA數據集的基礎上計算23種腫瘤類型的APS信息,在GEO芯片數據集上計算默克爾細胞癌、皮膚鱗癌和小細胞肺癌的APS信息。發現APS、TMB、TIGS與ORR顯著相關(圖4)。這些泛癌的ORR分析表明,TIGS在與免疫治療ORR的相關性方面優于TMB或APS。當使用第二種方法進行TIGS計算時,TIGS在泛癌ORR相關性方面仍然優于TMB和APS。
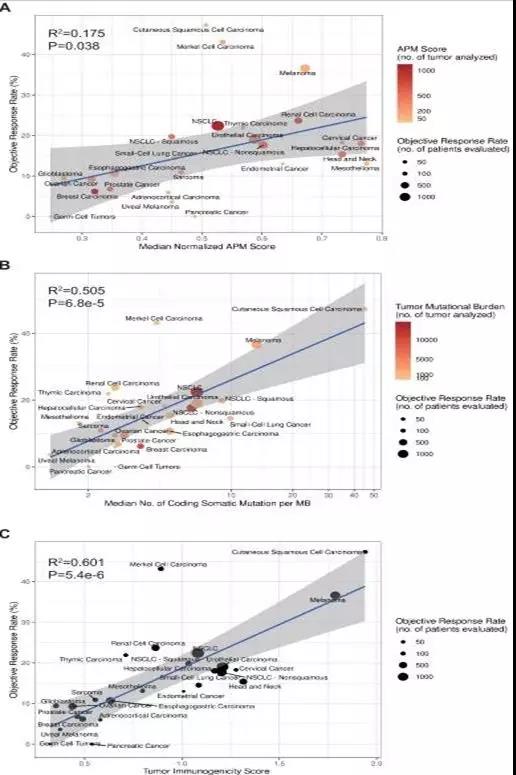
圖4
? ? ?? ⑤TIGS與ICI臨床反應的預測
? ?? 與TMB和APS相比,TIGS在不同類型癌癥中與免疫治療ORR的相關性增強。在此,作者進一步評估TIGS在預測單個癌癥患者ICI臨床反應中的表現,作者使用ROC曲線來觀察在TMB、TIDE或TIGS值的不同閾值下真實陽性率與假陽性率(圖5A-C)。與廣泛使用的ICI-response 標志物TMB相比,TIGS在所有三個ICI數據集上都取得了更好的性能(圖5A-C)。TIGS的預測能力可與兩組黑色素瘤數據集中的TIDE相媲美。然而,TIDE未能預測尿路上皮癌對免疫治療的反應,因此TIGS在尿路上皮癌數據集中表現更好(圖5C)。TIGS在三個數據集中也優于其他基于基因表達譜的免疫治療生物標志物,包括IIS、IFNG、ISG、RS, IFNG等(圖5D-F)。此外,APS本身也顯示了更優或類似的預測能力相比其他生物標記(圖5D-F)。在所有三個可用的數據集中,Kaplan Meier進一步比較了高低TIDE、TMB或TIGS水平患者的總體生存曲線(圖5G O)。
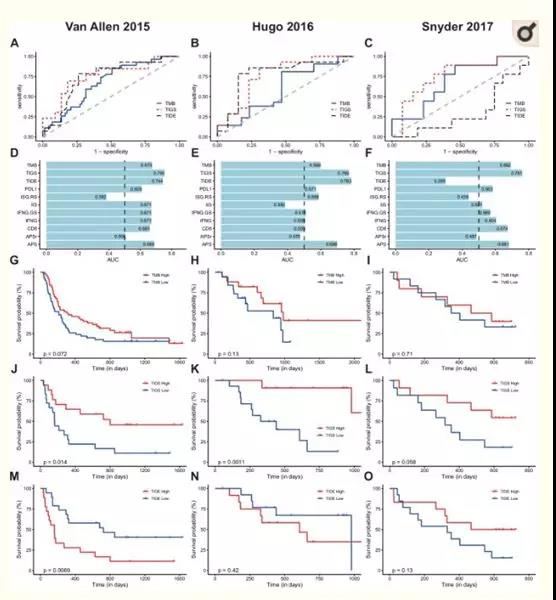
圖5
? ? ?? 4.結論
? ? ? 文章在泛癌中使用表達數據、臨床數據以及結合免疫評估,差異表達,GSEA,生存分析等方法最終識別出了有效的生物學標志物,并對標志物的性能進行了測評,工作量很大。無論是研究預后還是免疫的小伙伴都可以借鑒文章的研究方法以及角度。
? ? ?? 如涉及知識產權請與我司聯系??
|